时间:2019-07-04 00:13:39
1、填空题 (7分)“阿波罗号飞船”所用的氢氧燃料电池的电极应为:负极:2H2+4OH--4e-=4H2O,则正极反应为?;该电池工作时,通氢气的一极发生?反应(填氧化、还原),每转移4摩电子,电池内增加?摩水,负极附近溶液的PH值?,(填升高、降低、不变),正极附近? [H+]?(填升高、降低、不变)
参考答案:(7分)
正极反应为O2+2H2O+4e-=4OH-(2分),还原(1分),2(2分),降低(1分)降低(1分)
本题解析:略
本题难度:简单
2、选择题 锌铜原电池产生电流时,阴离子
A.移向Zn极,阳离子移向Cu极
B.移向Cu极,阳离子移向Zn极
C.和阳离子都移向Zn极
D.和阳离子都移向Cu极
参考答案:A
本题解析:
本题难度:困难
3、填空题 (8分)PM2.5是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
参考答案:(8分)
(1)pH="4" 。(2分)
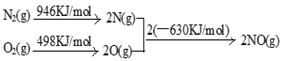
(2)N2(g)+O2(g)= 2NO(g) △H=+184kJ/mol (2分)
(3)SO2 + I2 + 2H2O = SO42- + 2I- + 4H+(2分) ; H2-2e-+2OH-=2H2O (2分)
本题解析:(1)根据电荷守恒规律,则PM2.5样本中氢离子的浓度是(2×4×10-5+3×10-5+2×10-5)-(2×10-5+4×10-6+6×10-6)=1×10-4mol/L,则pH=4;
(2)根据反应热=断键吸收的能量-成键时放出的能量,则N2和O2反应生成NO的反应热为(946+498)kJ/mol -2×630kJ/mol="+184" kJ/mol,则N2和O2反应生成NO的热化学反应方程式为N2(g)+O2(g)= 2NO(g) △H=+184kJ/mol;
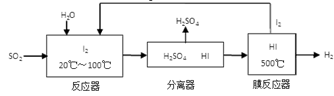
(3)反应器中发生的反应是二氧化硫与碘水的反应,生成硫酸和HI,离子方程式是SO2 + I2 + 2H2O = SO42- + 2I- + 4H+;氢氧燃料电池中,氢气在负极发生氧化反应,电解质溶液为KOH溶液,则负极是氢气失去电子与氢氧根离子结合为水,电极反应式为H2-2e-+2OH-=2H2O。
考点:考查电荷守恒规律的应用,反应热的计算,热化学方程式的书写,电化学反应原理的应用
本题难度:困难
4、选择题 将纯锌片和纯铜片按图所示插入稀硫酸中,以下有关叙述中正确的是? 
?[? ]
A.两装置中铜片表面都有气泡产生
B.乙装置中化学能转化为电能,甲装置中没有能量转化
C.两装置中铜片附近SO42-浓度都增大
D.两装置中发生的总反应相同
参考答案:D
本题解析:
本题难度:一般
5、选择题 如图所示,电流表指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,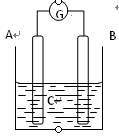
下列说法错误的是
A. B极为原电池的正极
B. A、B、C可能分别为Zn、Cu、稀盐酸
C. C中阳离子向A极移动
D. A极发生氧化反应
参考答案:C
本题解析:
答案:C
从题意看出,A电极为负极,B为正极
A、正确, B极为原电池的正极,得电子,发生还原反应;
B. 正确,A、B、C可能分别为Zn、Cu、稀盐酸,Zn失电子作负极,H+得电子生成H2
C. 不正确,C中阳离子向B极移动;
D. 正确,A极还原剂失去电子发生氧化反应。
本题难度:简单