时间:2019-07-04 00:10:44
1、选择题 物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是
[? ]
A.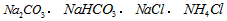
B.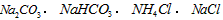
C.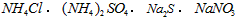
D.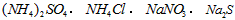
参考答案:D
本题解析:
本题难度:一般
2、选择题 已知:
(1)PH=2的次碘酸(HIO)溶液与PH=12的NaOH溶液等体积混合,所得溶液呈酸性;
(2)0.01mol/L的HIO3或HMnO4溶液与PH=12的Ba(OH)2溶液等体积混合所得溶液均呈中性。
则下列有关结论不正确的是
[? ]
A、HIO是强酸
B、HIO3是强酸
C、HMnO4是强电解质
D、HIO是弱酸
参考答案:A
本题解析:
本题难度:一般
3、选择题 下列溶液中微粒的物质的量浓度关系正确的是( )
A.NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+c(CO32-)+c(HCO3-)
B.pH=3的CH3COOH与pH=11的NaOH溶液等体积混合后的溶液中:c(H+)>c(OH-)
C.0.1mol/L的NH4Cl溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2c(Na+)=c(CH3COOH)+c(CH3COO-)
参考答案:BD
本题解析:
本题难度:一般
4、选择题 下列离子在pH=1的溶液中能够大量共存的是
A.F-、Na+、K+、Cl-
B.Ca2+、K+、Cl-、NO3-
C.Fe2+、NO3-、K+、Cl-
D.Al3+、Ag+、K+、Cl-
参考答案:B
本题解析:分析:据在pH=1的溶液中则可知溶液中有大量的H+,然后利用离子不能结合生成水、气体、沉淀来分析解答.
解答:A、F-、Na+、K+、Cl-中F-和H+结合形成HF弱电解质,所以离子不能大量共存,故A不符合;
B、Ca2+、K+、Cl-、NO3-、H+,离子间不发生反应,可以共存,故B符合;
C、Fe2+、NO3-、K+、Cl-、H+,中亚铁离子在酸性溶液中被硝酸根离子氧化,故C不符合;
D、Al3+、Ag+、K+、Cl-中氯离子和银离子反应生成氯化银沉淀,离子不能大量共存,故D不符合;
故选B.
点评:本题考查离子的共存问题,学生能利用复分解反应发生的条件来解答即可,还应注意隐含信息的挖掘,如本题PH=1的分析和应用.
本题难度:困难
5、选择题 下列各组物质的水溶液均能导电,但前者属是电解质、后者属于非电解质的是( )
A.CuSO4、HCl
B.CH3COOH、Na2O
C.NaClO、NH4HCO3
D.NaCl、NH3
参考答案:D
本题解析:
本题难度:一般