时间:2019-07-04 00:05:36
1、选择题 下列事实与胶体性质无关的是(?)
A.在豆浆里加入盐卤做豆腐
B.江河流入大海处易形成沙洲
C.一支钢笔使用两种不同牌子的墨水,易出现堵塞
D.往氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀
参考答案:D
本题解析:A、B、C都是胶体的聚沉,D中氯化铁和氢氧化钠溶液发生复分解反应生成红褐色氢氧化铁沉淀,和胶体性质无关系,答案选D。
点评:该题是基础性试题的考查,试题注重基础,贴近生活实际。有利于调动学生的学习积极性和学习兴趣。该题的关键是熟练掌握胶体的性质,并能灵活运用即可。
本题难度:简单
2、选择题 氯化铁溶液与氢氧化铁胶体具有的共同性质是
A.分散质颗粒直径都在1~100 nm之间
B.加热蒸干、灼烧后都有氧化铁生成
C.呈红褐色
D.能透过半透膜
参考答案:B
本题解析:FeCl3溶液中,粒子直径小于1 nm;FeCl3溶液呈棕黄色,Fe(OH)3胶体粒子不能透过半透膜。
本题难度:简单
3、填空题 (6分)某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质。
(1)该小组同学采用了以下操作制备胶体,请将空白处填写完整。
取一个烧杯,加入20mL蒸馏水,加热至沸腾,然后向烧杯中滴加5~6滴饱和_______? ___溶液,继续煮沸,至出现_____?____后,停止加热;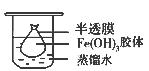
(2)将制得的胶体放入半透膜制成的袋内,如上左图所示,放置2min后,取少量半透膜外的液体于试管中,置于暗处,用一束强光从侧面照射,观察(填写“有”或“无”)_________ 丁达尔现象:再向试管中加入用稀硝酸酸化的硝酸银溶液,可观察到的现象为______________________________;
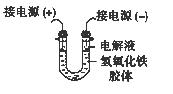
(3)将半透膜内的液体倒入U 型管中,如上右图所示,在液体上方加入少量电解液以保护胶体,接通直流电后,观察到的现象是(填“阴”或“阳”)_____极附近颜色逐渐变深,其原因是_____________________________________。
参考答案:(6分)
(1)FeCl3?红褐色
(2)无?有白色沉淀
(3)阴? Fe(OH)3胶体粒子带正电
本题解析:考查胶体的制备及胶体的性质。
(1)制备氢氧化铁胶体时,应该用新配制的饱和的氯化铁溶液,滴入沸腾的蒸馏水中,至出现红褐色后,停止加热。
(2)胶体不能透过半透膜,所以袋外液体不能产生丁达尔效应。由于氯离子能透过半透膜,所以加入硝酸银后能产生氯化银白色沉淀。
(3)氢氧化铁胶体的胶粒能吸附阳离子,因此带正电荷,所以胶粒向阴极移动,即阴极周围颜色逐渐变深。
本题难度:一般
4、选择题 下列说法不正确的是
A.CCl4是由极性键构成的非极性分子
B.胶体粒子可以透过滤纸但不能透过半透膜
C.氯水中通入SO2气体发生反应,说明Cl2的氧化性强于S
D.需要加热才能发生的反应一定是吸热反应
参考答案:CD
本题解析:A、正确;B、正确;C、氧化还原反应中氧化剂的氧化性强于氧化产物, 氯水中通入SO2气体发生反应,说明Cl2的氧化性强于氧化产物H2SO4,错误;D、反应条件与反应吸热和放热反应没有直接关联,错误。
本题难度:一般
5、选择题 下列有关物质的类属判断合理的是
①硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
③棉、麻、羊毛、聚乙烯均属于天然高分子材料
④根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
⑤根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应.
A.只有②④
B.只有②⑤
C.只有①③⑤
D.只有②③④⑤
参考答案:B
本题解析:分析:①根据酸、碱、盐、氧化物的概念来解答;
②根据非电解质、强电解质以及弱电解质的概念来回答;
③根据聚乙烯均属于合成高分子材料
④分散系分为胶体、浊液和溶液是根据分散质粒子直径大小;
⑤根据反应中是否有电子转移将化学反应分为是氧化还原反应和非氧化还原反应.
解答:①硫酸电离出的阳离子全为氢离子,属于酸;纯碱由钠离子和碳酸根离子组成,属于盐;醋酸钠由钠离子和醋酸根离子组成属于盐;生石灰由钙和氧两种元素组成的化合物,属于氧化物,故错误;
②蔗糖在水溶液和熔融态下均不导电,属于非电解质,硫酸钡在熔融态时完全电离,属于强电解质,水只能部分电离,属于弱电解质,故正确;
③聚乙烯均属于合成高分子材料,不是天然高分子材料,故错误;
④分散系分为胶体、浊液和溶液是根据分散质粒子直径大小,而不是丁达尔效应,故错误;
⑤根据反应中是否有电子转移将化学反应分为是氧化还原反应和非氧化还原反应,故正确;
故选B.
点评:本题考查物质和化学反应的分类,题目难度不大,注意物质的分类角度.
本题难度:简单