时间:2019-07-04 00:03:24
1、简答题 下图中A~J分别代表有关反应中的一种物质,它们均为中学化学中的常见物质.已知A~E和F~J中分别含有同一种元素.请填写下列空白: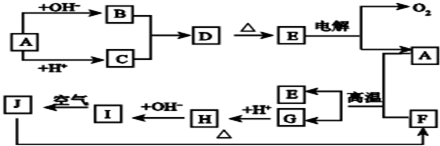
(1)画出A的原子结构示意图______.
(2)指出G在元素周期表中的位置关系______
(3)写出B和C反应的离子方程式:______
(4)写出A?和F发生反应的化学方程式______.
参考答案:由A既能与酸反应又能与碱反应,且E电解生成A和氧气,则A为Al,E为Al2O3,D分解生成E,所以D为Al(OH)3,B中含AlO2-,C中含Al3+;由转化图可知,A与F的反应为铝热反应,F为Fe2O3,G为Fe,H中含有Fe2+,I为Fe(OH)2,I能被氧化,J分解生成F,则J为Fe(OH)3,
(1)Al的原子序数为13,其原子结构示意图为,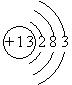
,故答案为:
;
(2)G为Fe,原子序数为26,位于第四周期第ⅤⅢ族,故答案为:第四周期第ⅤⅢ族;
(3)B中含AlO2-,C中含Al3+,二者反应的离子反应为3AlO2-+Al3++6H2O═4Fe(OH)3↓,故答案为:3AlO2-+Al3++6H2O═4Fe(OH)3↓;
(4)A与F的反应为铝热反应,该反应为2Al+Fe2O3?高温?.?Al2O3+2Fe,故答案为:2Al+Fe2O3?高温?.?Al2O3+2Fe.
本题解析:
本题难度:一般
2、填空题 (12分)已知:①A、B、C、D四种物质均含有元素X,可能还含有元素Y或Z。元素Y、X、Z的原子序数依次递增且不超过20。② X在A、B、C、D中的化合价分别为0、-1、+1、+5。③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。④化合物D在二氧化锰催化下受热分解,可制得元素Y的单质。请回答下列问题:
(1)写出B、C、D的化学式:B? __?,C?,D?。
(2)用电子式表示C的形成过程??。
参考答案:(12分)⑴KCl;KClO;KClO3?(2)略
本题解析:略
本题难度:一般
3、填空题 Ⅰ.下列化合物中,含有非极性共价键的离子化合物是? ( )。
A.CaC2
B.N2H4
C.Na2S2
D.NH4NO3
Ⅱ.图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示。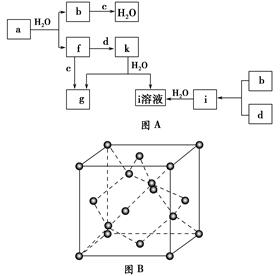
回答下列问题:
(1)图B对应的物质名称是________,其晶胞中的原子数为________,晶体类型为________。
(2)d中元素的原子核外电子排布式为________。
(3)图A中由二种元素组成的物质中,沸点最高的是________,原因是________________________________________________________________________,该物质的分子构型为________,中心原子的杂化轨道类型为________。
(4)图A中的双原子分子中,极性最大的分子是________。
(5)k的分子式为________,中心原子的杂化轨道类型为________,属于________分子(填“极性”或“非极性”)。
参考答案:Ⅰ.AC
Ⅱ.(1)金刚石 8 原子晶体 (2)1s22s22p63s23p5
(3)H2O 分子间形成氢键 V形(或角形) sp3
(4)HCl (5)COCl2 sp2 极性
本题解析:Ⅱ(1)每个原子周围有4个键,判断为金刚石。(2)a为C,则b为H2、c为O2,因i是常见的酸,只由b、d形成可判断为盐酸,则d为Cl2。(3)除a、b、c、d外,f为CO,g为CO2,i为HCl,而k与水反应生成CO2与盐酸,该反应没在教材中出现过,且由f、d反应得到,应含C、O、Cl三种元素,只能判断为COCl2(在历届高考中有出现过)。两元素形成的物质中,水是液态。(4)所有双原子分子中,只有H、Cl电负性差值最大,因而极性最大。(5)COCl2中羰基的平面结构显示其为sp2杂化。
本题难度:困难
4、填空题 (12分)物质A-L之间的转化关系如图,部分反应物和生成物及反应条件已省略。化合物A是由三种元素组成的一种矿石 www.91eXam.org的主要成分。A在氧气中高温煅烧生成B、C、D。B为砖红色固体,D、I均为红色固体,E、I、K是三种常见金属,其中组成E的元素是地壳中含量最高的金属元素。L可作净水剂,向L溶液中加入BaCl2溶液,会生成不溶于稀硝酸的白色沉淀,H溶液呈蓝色。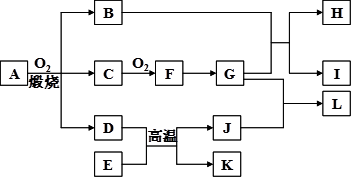
请回答下列问题:
(1)写出E和G的化学式:E?、G?。
(2)L可用作净水剂的原因是?(用离子方程式表示)。
(3)写出B和G反应的化学方程式?。
(4)D+E→K+J的反应中放出大量的热,这类反应被称为?反应,举出这类反应的一个应用实例:?。
(5)A的相对分子质量为184,A与O2反应得到B、C、D三种物质的物质的量之比为1︰4︰1 ,某种检验葡萄糖的反应中含有B生成,则A的化学式为?。
,某种检验葡萄糖的反应中含有B生成,则A的化学式为?。
(6)过量的I与含n molG的浓G溶液共热生成m molC,若给反应后的溶液中加入足量的K的粉末,则溶解掉K的质量为?g(用含n和m的代数式表示)。
参考答案:(12分)(1)? Al?、? H2SO4?
(2)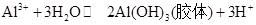 ?
?
(3)Cu2O+H2SO4=CuSO4+Cu+H2O?
(4)?铝热?、?焊接钢轨或冶炼金属
(5)? CuFeS2?(6)? 56(n-m)
本题解析:略
本题难度:一般
5、填空题 有三种固体物质和五种溶液:固体是铁粉、铜粉、氢氧化铜;溶液是CuSO4溶液、NaOH溶液、FeSO4溶液、H2SO4溶液、Na2SO4溶液.它们中的几种物质在常温下相互转化关系如下:
(1)溶液A+溶液C→固体甲+溶液D
(2)固体乙+溶液B→溶液E+氢气
(3)固体甲+溶液B→溶液C+水
试推断溶液中A、B、C、D、E及固体甲、乙、丙的名称.
A、______?B、______?乙、______?丙、______
写出反应(1)(3)的方程式:
(1)______(3)______.
参考答案:依据转化关系,固体乙+溶液B→溶液E+氢气,可知固体乙只能是Fe,溶液B为H2SO4;溶液E为FeSO4;固体甲+溶液B→溶液C+水,可知甲为Cu(OH)2;溶液C为CuSO4;溶液A+溶液C→固体甲+溶液D,所以溶液A是NaOH溶液,溶液D是Na2SO4溶液;综上所述推断出各物质为:A、NaOH溶液;B、H2SO4溶液;C、CuSO4溶液;D、Na2SO4溶液;E、FeSO4溶液;甲、Cu(OH)2;乙、Fe;丙、Cu.
故答案为:A、氢氧化钠溶液;B、稀硫酸;乙、铁粉;丙、铜粉;
依据判断出物质,写出反应(1)(3)的化学方程式为:2NaOH+CuSO4=Na2SO4+Cu(OH)2↓;Cu(OH)2+H2SO4=CuSO4+2H2O;
故答案为:2NaOH+CuSO4=Na2SO4+Cu(OH)2↓;Cu(OH)2+H2SO4=CuSO4+2H2O;
本题解析:
本题难度:一般