时间:2019-07-03 23:53:44
1、选择题 下列物质中,既能与稀硫酸反应,又能与氢氧化钠溶液反应的是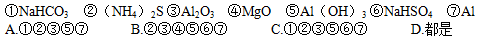
参考答案:A
本题解析:既能与稀硫酸反应,又能与氢氧化钠溶液反应的物质一般包括:铝及其氧化物、氢氧化物、弱酸的铵盐、多元弱酸的酸式盐,答案为A
本题难度:一般
2、简答题 (14分)
一位同学在复习时遇到这样一道习题:某无色溶液中可能含有“H+、OH-、Na+、NO3-”,加入铝粉后,只产生H2,问该无色溶液中能大量存在哪几种离子。
(1)加入铝粉产生H2,说明铝具有______(填“氧化性”或“还原性”)。
(2)该同学分析:若H+大量存在,则NO3-就不能大量存在。
设计实验证实如下:
| 装 置 | 现 象 |
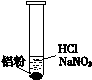 | ⅰ. 实验初始,未见明显现象 ⅱ. 过一会儿,出现气泡,液面上方呈浅棕色 ⅲ. 试管变热,溶液沸腾 |
| 实?验 | 内?容 | 现?象 |
| 实验1 | ?将湿润KI—淀粉试纸置于空气中 | 未变蓝 |
| 实验2 | 用湿润KI—淀粉试纸检验浅棕色气体 | 试纸变蓝 |
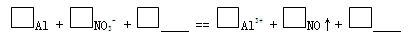
| 装 置 | 现 象 |
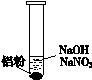 | ⅰ. 实验初始,未见明显现象 ⅱ. 过一会儿,出现气泡,有刺激性气味 |
参考答案:(14分)
(1)还原性
(2)① 6H+ + Al2O3 ="=" 2Al3+ + 3H2O
② a.NO2
b. 对比实验,排除氧气使湿润的淀粉KI试纸变蓝的可能
c. 1,1,4H+,1,1,2H2O
(3)① NH3
② 8Al +3NO3- + 5OH-+ 2H2O ="=" 3NH3↑+ 8AlO2-
(4)2Al +2NaOH + 2H2O ="=" 2NaAlO2 + 3H2↑
本题解析:(1)加入铝粉产生H2,说明铝具有还原性;
(2)① 盐酸溶解Al2O3薄膜,生成氯化铝和水,离子方程式为6H+ + Al2O3 ="=" 2Al3+ + 3H2O
②a.、浅棕色气体是NO2
b、实验1的目的是与实验2作对比,排除实验2中氧气使湿润的淀粉KI试纸变蓝的可能;
c、根据所学知识,Al与硝酸反应生成NO,所以反应物的空白应填写“H+”,所以产物中应有水存在,再根据得失电子守恒法、观察法配平方程式即可。配平后的离子方程式为:Al+NO3-+4H+=Al3++NO↑+2H2O
(3)①用湿润红色石蕊试纸检验,试纸变蓝。则使湿润红色石蕊试纸变蓝的气体是NH3;
② 该反应有氨气产生,说明Al与氢氧化钠溶液、硝酸钠溶液发生了氧化还原反应,离子方程式为:8Al +3NO3- + 5OH-+ 2H2O ="=" 3NH3↑+ 8AlO2-;
(4)Al与单一氢氧化钠溶液反应的化学方程式是2Al +2NaOH + 2H2O ="=" 2NaAlO2 + 3H2↑。3-的氧化性的判断,氨气的检验,化学方程式、离子方程式的书写
本题难度:一般
3、选择题 铝分别与足量的氢氧化钠和稀盐酸溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的NaOH和HCl物质的量之比为( )
A.2:1
B.3:1
C.1:1
D.1:3
参考答案:令生成的氢气的物质的量为3mol,则:
? 2Al+6HCl=2AlCl3+3H2↑,
?6mol? 3mol
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
? 2mol?3mol
所以所取氢氧化钠和盐酸溶液中NaOH、HCl的物质的量的之比为2mol:6mol=1:3;
故选D.
本题解析:
本题难度:简单
4、选择题 下列物质中,既能与盐酸又能与NaOH溶液反应的是
A.氢氧化铝
B .硅酸钠
C.碳酸钠
D.二氧化硅
参考答案:A
本题解析:分析:根据物质间的反应进行判断,中学常见的既能与酸反应又能与碱反应的物质主要有:
①两性物质:Al2O3、ZnO、Al(OH)3、Zn(OH)2、氨基酸、蛋白质等;
②多元弱酸的酸式盐:NaHCO3、KHS、KHSO3、NaH2PO4等;
③弱酸的铵盐及其酸式盐:(NH4)2S、NH4HS、(NH4)2CO3、NH4HCO3、CH3COONH4等;
④某些具有两性的金属:Zn、Al等;
⑤某些非金属:Si、S等;
⑥其它一些物质.如:a、某些盐类物质既与酸反应,又与碱反应;
b、个别酸性氧化物SiO2;
c、具有还原性的无氧酸:H2S、HI等与氧化性酸反应、与碱反应;
d、具有氧化性酸:浓H2SO4、HNO3等与还原性酸反应、与碱反应,以此解答本题.
解答:A.氢氧化铝是两性氢氧化物,能与盐酸反应生成氯化铝与水,与氢氧化钠反应生成偏铝酸钠与水,故A符合;
B.硅酸钠与盐酸反应生成硅酸与氯化钠,不能与氢氧化钠反应,故B不符合;
C.碳酸钠与盐酸反应生成氯化钠、二氧化碳与水,不能与氢氧化钠反应,故C不符合;
D.二氧化硅与氢氧化钠反应生成硅酸钠与水,不能与盐酸反应,故D不符合;
故选A.
点评:本题考查了物质的性质,难度不大,旨在考查学生对知识的理解识记与知识归纳,明确物质的性质是解本题的关键,注意基础知识的积累.
本题难度:简单
5、填空题 (16分 )镁可与其他金属构成合金。镁铝合金的强度高,机械性能好。有“国防金属”的美誉。自然界中的镁元素主要存在于海水中。海水中镁的总储量约为1.8×1015?t。从海水中(主要含含Na+,Cl—,Mg2+等离子)提取镁的工艺流程图如下:
)镁可与其他金属构成合金。镁铝合金的强度高,机械性能好。有“国防金属”的美誉。自然界中的镁元素主要存在于海水中。海水中镁的总储量约为1.8×1015?t。从海水中(主要含含Na+,Cl—,Mg2+等离子)提取镁的工艺流程图如下:
(1)A物质的化学式为?。操作1的名称为?。
(2)试写出向固体A中加入足量盐酸的离子方程式?。
(3)该反应的副产物主要有?等。
(4)若开始得到的固体A的质量为116g,不考虑物质的损失,则最后生成的Mg的物质的量为?mol。
参考答案: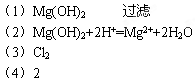
本题解析:略
本题难度:一般