时间:2019-07-03 23:52:42
1、填空题 在一个容积固定为2L的密闭容器中,发生反应 △H=?。反应情况记录如下表:
△H=?。反应情况记录如下表:
| 时间 | c(A)/mol  L-1 L-1 | c(B)/mol L-1 | c(C)/mol L-1 |
| 0min | 1 | 3 | 0 |
第2m in in | 0.8 | 2.6 | 0.4 |
| 第4min | 0.4 | 1.8 | 1.2 |
| 第6min | 0.4 | 1.8 | 1.2 |
| 第8min | 0.1 | 2.0 | 1.8 |
| 第9min | 0.05 | 1.9 | 0.3 |
参考答案:
(1)1? 2? 2(3分)
(2)0.2(2分)
(3)①使用催化剂或升高温度(4分)②增加B的浓度(2分)③减小C的浓度(2分)
(4) -196.6 kJ·mol-1(2分)
本题解析:
略
本题难度:一般
2、选择题 T °C时,在2 L密闭容器中,X、Y、Z三种气体的物质的量随时间变化如下图I所示。若起始时加入一定量的Y,在不同温度下改变X的量时Z的体积分数变化情况如图II所示。则下列结论正确的是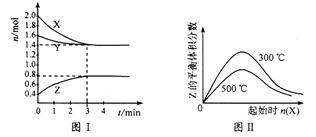
A.该反应的化学方程式为: 2X(g) + Y(g) 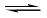 2Z(g)
2Z(g)
B.反应进行的前3min内,用X表示的平均反应速率v(x)=0.067mol/(L·min)
C.由图II可知,其他条件不变,增大X的量时Y的转化率先增大后减小
D.其他条件不变,升髙温度,平衡逆向移动
参考答案:D
本题解析:根据图1可知,平衡时X、Y分别减少了0.6mol、0.2mol,Z增加了0.4mol,所以方程式为3X(g) + Y(g) 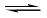 2Z(g),A不正确。前3min内,用X表示的平均反应速率v(x)=
2Z(g),A不正确。前3min内,用X表示的平均反应速率v(x)=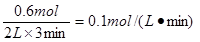 ,B不正确。增加X的量,平衡向正反应方向移动,Y的转化率增大,C不正确。根据图像2可知,温度越高Z的含量越低,说明升高温度平衡向逆反应方向移动,即正反应是放热反应,D正确,答案选D。
,B不正确。增加X的量,平衡向正反应方向移动,Y的转化率增大,C不正确。根据图像2可知,温度越高Z的含量越低,说明升高温度平衡向逆反应方向移动,即正反应是放热反应,D正确,答案选D。
本题难度:一般
3、选择题 反应:A = 2B中,A、B的浓度变化如图所示。则2min以内的平均反应的速率为( ? )

参考答案:D
本题解析:
本题难度:简单
4、选择题 右图表示可逆反应mA(g)+nB(g) pC(g)在不同温度(T)、压强(P)下,生成物C的质量分数C%的变化情况。下列关于该正反应热效应及方程式中A. B. C的化学计量数的判断中,正确的是
pC(g)在不同温度(T)、压强(P)下,生成物C的质量分数C%的变化情况。下列关于该正反应热效应及方程式中A. B. C的化学计量数的判断中,正确的是
A.吸热反应,m+n<p? B.吸热反应,m+n>p
C.放热反应,m+n<p? D.放热反应,m+n>p
参考答案:C
本题解析:根据图像可知,温度为T2时反应首先达到平衡状态,则T2大于T1。温度高C的百分含量低,这说明升高温度平衡逆反应方向移动,因此正反应是放热反应;同样分析可知,压强为P2时反应首先达到平衡状态,则P2大于P1。压强高C的百分含量低,这说明增大压强平衡逆反应方向移动,因此正反应是体积增大的可逆反应,即m+n<p,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,旨在考查学生灵活运用基础知识解决实际问题的能力。该类试题需要明确的是在分析有关图像时应该注意:一、ν-t 图像或 c-t 图像:1.ν-t 图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。?二、平衡图像 1.出现拐点的图像:分析依据“先拐先平”。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂等)。
本题难度:一般
5、选择题 可逆反应:4A(s)+3B(g)?2C(g)+D(g)(放热反应),2s末,B的浓度减小0.6mol/L,下列说法正确的是( )
A.在2s时,A与B物质反应速率之比为4:3
B.其他条件不变,升高温度,正反应速率减小,逆反应速率增大
C.在2s时,D的物质的量一定增加0.2mol
D.若容器的温度和体积保持不变,反应前后容器的压强相等
参考答案:A、由于A物质为固体,不能用来表示反应速率,故A错误;
B、升高温度,正逆反应速率都增大,故B错误;
C、2s时,D物质的量浓度一定增加0.2mol/L,但是不能确定物质的量的增加量,故C错误;
D、压强之比等于物质的量之比,反应前后气体的物质的量不变,所以反应前后容器压强相等,故D正确.
故选D.
本题解析:
本题难度:简单