时间:2019-07-03 23:49:00
1、选择题 在溶液(NH4)2SO4中,离子浓度大小顺序正确的是
A.c(NH4+)> c(SO42-)>c(H+)>c(OH-)
B.c(SO42-)>c(NH4+)>c(OH-)>c(H+)
C.c(NH4+)>c(SO42-)>c(OH-)>c(H+)
D.c(SO42-)>c(H+)>c(NH4+)>c(OH-)
2、填空题 (8分)
I.已知在25℃时,HF、HCN和H2CO3的的电离平衡常数如表所示:
(1)写出碳酸的第一级电离平衡常数表达式:K1= 。
(2)①往Na2CO3溶液中加入足量HF溶液,发生反应的离子方程式:
②往NaCN溶液中通入少量CO2,发生反应的离子方程式: &# www.91eXam.org160;
II. 用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是 。
3、填空题 (14分)碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) =4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·molˉ1
CH4(g) + 4NO(g) = 2N2(g)+CO2(g) + 2H2O(g) ΔH2
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1734 kJ,则ΔH2= ;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为:Fe2O3(s) + 3CH4(g) 2Fe(s) + 3CO(g) +6H2(g)
2Fe(s) + 3CO(g) +6H2(g)
4、填空题 (10分)(1)常温下,向20 mL 0.2 mol·L-1H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空: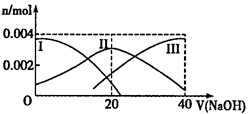
①当V(NaOH)=20mL时,溶液中离子浓度的大小关系: ___________________;
②等体积、等物质的量浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水_________(填“大”、“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入___________。
(2)氨气分解反应的热化学方程式如下:2NH3(g) N2(g)+3H2(g) △H=+92.4kJ·mol-1研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
N2(g)+3H2(g) △H=+92.4kJ·mol-1研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
①不同催化剂存在下,氨气分解反应的活化能最大的是__________(填写催化剂的化学式)。
②恒温(T1)恒容时,用Ni催化分解初始浓度为c0的氨气,并实时监测分解过程中氨气的浓度。计算后得氨气的转化率α(NH3)随时间t变化的关系曲线(见图2)。请在图2中画出:如果将反应温度提高到T2,Ru催化分解初始浓度为c0的氨气过程中α(NH3)—t的总趋势曲线(标注Ru—T2)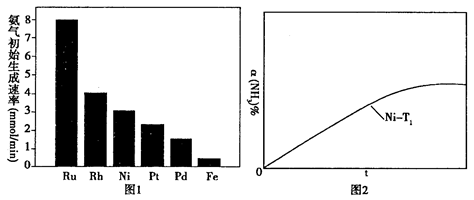
③假设Ru催化下温度为T1时氨气分解的平衡转化率为40%,则该温度下此分解反应的平衡常数K与c0的关系式是:K=_____________。
5、选择题 为了配制NH4+与Cl-浓度比为1∶1的溶液,可在溶液NH4Cl中加入
①适量HCl,②适量NaCl,③适量氨水,④适量NaOH。
A.①②
B.③
C.③④
D.④