时间:2019-07-03 23:46:10
1、简答题 在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热量.已知0.4mol液态肼和足量双氧水反应生成氮气和水蒸气时放出256.65KJ的热量.
(1)写出肼和过氧化氢的结构式?肼______,过氧化氢______.
(2)上述反应应用于火箭推进剂,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是______.
(3)写出肼和双氧水反应的热化学方程式______.
(4)已知H2O(l)═H2O(g);△H=+44KJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是______.
(5)发射卫星时可用肼(N2H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水.已知:
N2?(g)+2O2(g)=2NO2?(g)△H=+67.7kJ/mol
N2H4(g)+O2?(g)=N2(g)+2H2O?(g)△H=-543kJ/mol
H2?(g)+F2(g)=HF?(g)△H=-538kJ/mol
2H2?(g)+O2?(g)=2H2O?(g)△H=-484kJ/mol
则肼与NO2完全反应的热化学方程式为______.有人认为若用F2?(g)代替二氧化氮作氧化剂,则反应释放能量更大,N2H4?(g)和F2?(g)反应的热化学方程式:______.
2、选择题 相关数据如下表:
| | H2(g) | Br2(g) | HBr(g) |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | 200 | 369 |
3、简答题 20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过一个高能量的过渡态.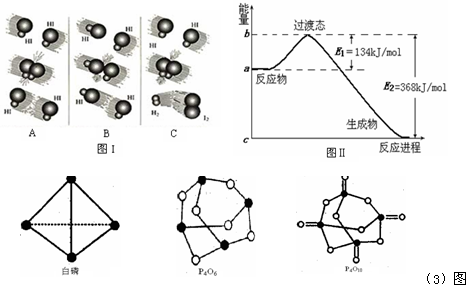
(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是______(选填“A”、“B”或“C”);
(2)图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:______;
(3)下表是部分化学键的键能数据:
化学键
P-P
P-O
O=O
P=O
键能/kJ?mol-1
198
360
498
X
已知白磷的燃烧热为2982kJ/mol,白磷(P4)、P4O6、P4O10结构如下图所示,则上表中X=______.
(4)0.5mol白磷(P4)与O2完全反应生成固态P4O6放出的热量为______kJ.
4、选择题 已知充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是
[? ]
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=-4b kJ/mol
B.C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);△H=2b kJ/mol
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=-2b kJ/mol
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=b kJ/mol
5、简答题 写出下列热化学方程式
(1)已知25℃、101kpa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.写出25℃、101kPa时的辛烷燃烧热的热化学方程式______.
(2)在一定条件下,N2和H2完全反应生成1molNH3放热46.0kJ热量.写出氨分解为氢气和氮气的热化学方程式______.