时间:2019-07-03 23:46:10
1、选择题 通常人们把拆开某化学键所吸收的能量看成该化学键的键能,键能的大小可用于估算化学反应的 反应热△H(化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之 和的差)。一些化学键的键能数据如下。 下列热化学方程式正确的是

[? ]
 NH3 (g) △H=-421.9 kJ·mol-1
NH3 (g) △H=-421.9 kJ·mol-1  2NH3 (g) △H = -620. 8 kJ·mol-1
2NH3 (g) △H = -620. 8 kJ·mol-1  1/2N2(g)+3/2H2(g) △H = +45.4 kJ·mol-1
1/2N2(g)+3/2H2(g) △H = +45.4 kJ·mol-1  2NH3( g) △H=-45.4 kJ·mol-1
2NH3( g) △H=-45.4 kJ·mol-1参考答案:C
本题解析:
本题难度:一般
2、填空题 欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
__C+__K2Cr2O7+__ →__CO2↑+ __K2SO4 + __Cr2(SO4)3+__H2O
请完成并配平上述化学方程式。
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①下列措施中有利于增大该反应的反应速率的是 _______;
A.随时将CH3OH与反应混合物分离
B.降低反应温度
C.增大体系压强
D.使用高效催化剂
②已知: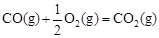 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1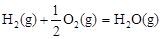 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为 ;
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答: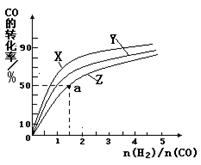
参考答案:
本题解析:
本题难度:困难
3、选择题 下列说法正确的是
[? ]
A.热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量
B.热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据
C.书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态
D.凡是化合反应都是放热反应,分解反应都是吸热反应
参考答案:C
本题解析:
本题难度:简单
4、简答题 (1)根据你掌握的知识判断,下列说法正确的是______.
A.用新制备的Cu(OH)2悬浊液与病人尿液共热,可检验人尿液中是否含有葡萄糖
B.用量筒量取5.0ml.液体时俯视读数,会使液体体积小于5.0mL
C.用天平称量20.59某物质,砝码放在左盘,药品放在右盘
D.10%的硫酸和90%的硫酸等体积混合可配得50%的硫酸溶液
E.用灼烧闻气味的方法不能区别合成纤维和羊毛
F.紫外线、医用酒精能杀菌消毒,是因为使细菌的蛋白质性质改变
(2)将足量AgCl分别放入:①5ml水,②10ml 0.2mol?L-1 MgCl2溶液,③20ml 0.5mol?L-1 NaCl溶液,④40ml 0.1mol?L-1盐酸中溶解至溶液饱和,各溶液中Ag+的浓度分别为a、b、c、d,它们由大到小的排列顺序是______.
(3)已知:
N2(g)+3H2((g)?2NH3(g)△H1=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H2=-523.6kJ/mol
H2O(g)=H2O(l)△H3=-44.0kJ/mol
根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应生成氨气,试写出此反应的热化学方程式:______.
参考答案:(1)A.葡萄糖与新制备氢氧化铜浊液在加热条件下可发生氧化还原反应,可鉴别,故A正确;
B.俯视时,读数偏大,导致体积偏小,故B正确;
C.应为左物右码,故C错误;
D.不同浓度的硫酸密度不同,10%的硫酸和90%的硫酸等体积混合,质量分数大于50%,故C错误;
E.蛋白质灼烧时具有烧焦的羽毛气味,可用于鉴别,故E错误;
F.紫外线、医用酒精可使蛋白质变性,则可用于杀菌消毒,故F正确;
故答案为:ABF;
(2)饱和溶液中Ksp(AgCl)=c(Ag+)×c(Cl-),溶液中c(Cl-)越大,则c(Ag+)越小,题中c(Cl-)大小顺序为③>②>④>①则Ag+的浓度由大到小的排列顺序是a>d>b>c,
故答案为:a>d>b>c;
(3)已知:
①N2(g)+3H2((g)?2NH3(g)△H1=-92.4kJ/mol;
②2H2(g)+O2(g)=2H2O(g)△H2=-523.6kJ/mol;
③H2O(g)=H2O(l)△H3=-44.0kJ/mol,
利用盖斯定律,将①×2-②×3-③×6,得2N2(g)+6H20(1)=4NH3(g)+302(g)△H=(-92.4kJ/mol)×2-(-523.6kJ/mol)×3-(-44.0kJ/mol)×6
=+1650kJ/mol,
故答案为:2N2(g)+6H20(1)=4NH3(g)+302(g)△H=+1650kJ/mol.
本题解析:
本题难度:一般
5、选择题 下列各组热化学方程式中,化学反应的ΔH前者小于后者的是
①C(s)+ O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2
O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2
②S(g)+O2(g) ===SO2(g);ΔH3 S(s)+O2(g) ===SO2(g);ΔH4
③CaO(s)+H2O(l) ===Ca(OH)2(s);ΔH5 CaCO3(s) ===CaO(s)+CO2(g);ΔH6
A.②
B.①②
C.①③
D.②③
参考答案:D
本题解析:碳完全燃烧放出的热量多,但放热反应中△H<0,因此放热越多△H越小,即ΔH前者大于后者,①不正确;由于气态硫的总能量高于固态硫的总能量,因此气态硫燃烧放出的热量多,则ΔH前者小于后者,②正确;生石灰溶于水是放热反应,碳酸钙分解是吸热反应,△H>0,则ΔH前者小于后者,③正确,答案选D。
考点:考查反应热的大小比较
本题难度:一般