时间:2019-07-03 23:43:19
1、选择题 我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为4Al+3O2+6H2O=4Al(OH)3。下列说法不正确的是
A.正极反应式为O2+2H2O+4e一=4OH—
B.以网状的铂为正极,可增大与氧气的接触面积
C.电池工作时,电流由铝电极沿导线流向铂电极
D.该电池通常只需更换铝板就可继续使用
参考答案:C
本题解析:A、根据电池的总反应,写出各电极的反应式:Al作负极:4Al-12e-+12OH-=4Al(OH)3,铂网作正极:3O2+6H2O+12e-=12OH-,说法正确;B、根据题目信息铂网作正极,网状的作用可增大与氧气的接触面积,说法正确;C、根据原电池的工作原理,电子从负极经导线流向正极,e-从铝经导线流向铂,而电流是从正极流向负极(铂流向的铝),说法错误;D、根据原电池的工作原理,负极不断溶解消耗,只要更换铝板就可继续使用,说法正确。
考点:考查原电池的工作原理、电极反应式的书写等相关知识。
本题难度:一般
2、填空题 .⑴今有2H2+O2 2H2O反应,设计成燃料电池,则负极通的应是?,正极通的应是?,电极反应式为:?、?。
2H2O反应,设计成燃料电池,则负极通的应是?,正极通的应是?,电极反应式为:?、?。
⑵如把KOH改为稀H2SO4作电解质,则电极反应式为:?、
?。⑴和⑵的电解液不同,反应进行后,其溶液的PH值变化为?、?。
⑶如把H2改为甲烷,KOH作电解质,则负极反应式为:?。
参考答案::⑴H2? O2?负极:2H2+4OH-→4H2O+4e-;正极:O2 + 2H2O + 4e-→ 4OH-;⑵负极:2H2→4H++4e-;正极:O2+4H++4e-→2H2O;⑴中变小,⑵中变大;⑶负极:CH4+10OH―=CO32-+7H2O+8e―。
本题解析:依据原电池的原理应用。首先考虑原电池反应所依据的氧化还原反应,再考虑产物与电解质溶液的反应。⑴⑵两问中原电池反应为2H2+O2=2H2O,最后一问原电池反应为CH4+2O2+2KOH=K2CO3+3H2O。
本题难度:一般
3、选择题 下图是氢氧燃料电池构造示意图。关于该电池的说法不正确的是
[? ]
A.a极是负极
B.正极的电极反应是:O2+2H2O+4e-==4OH-
C.电子由b通过灯泡流向a
D.氢氧燃料电池是环保电池
参考答案:BC
本题解析:
本题难度:一般
4、填空题 (14分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H= 。(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
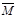 )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。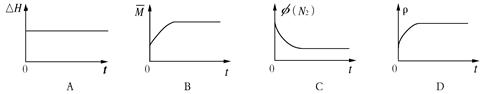
参考答案:(14分)
(1)(3△H1+2△H2)/5(2分)
(2)①<(2分)
②0.1mol·L-1·min-1 (2分) 25%(2分)
③BC(2分)
(3)①N2H4-4e?===N2↑+4H+(2分) ②0.5(2分)
本题解析:(1)根据盖斯定律,将NO消去,可得4NH3(g)+3O2(g)=2N2(g)+6H2O(l)
△H=(3△H1+2△H2)/5;
(2)①T2到T1变化时,氨气的物质的量增大,说明改变温度,平衡正向移动,而正向是放热反应,所以温度变化是降低温度,则T1<T2;
②在T2 K下,经过10min达到化学平衡状态,氨气的物质的量是2mol,根据反应的化学方程式,则消耗氢气的物质的量是3mol,则0~10min内H2的平均速率v(H2)=3mol/3L/10min=0.1mol·L-1·min-1;消耗氮气的物质的量是1mol,所以氮气的转化率是1mol/4mol×100%=25%;
③A、反应的化学方程式固定,则反应热不变,所以不能判断为平衡状态,错误;B、该反应是气体的物质的量减小的可逆反应,所以气体的平均摩尔质量增大,达到平衡时,气体的平均摩尔质量不变,正确;C、随反应的进行,氮气的体积分数不断减小,达到平衡时,保持不变,正确;D、容器的体积不变,则气体的密度一直不变,所以不能判断为平衡状态,错误,答案选BC;
(3)①根据装置图中氢离子的移动方向判断M区为负极区,则N2H4在负极发生氧化反应,失去电子生成氮气和氢离子,电极反应式是N2H4-4e?==N2↑+4H+;
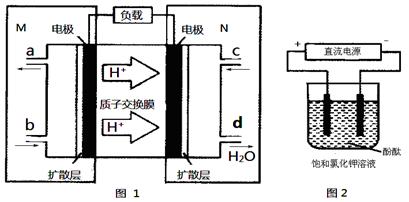
②用该电池电解氯化钠溶液,化学方程式是2NaCl+2H2O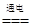 2NaOH+H2↑+Cl2↑, 500mL的溶液的pH=13,则氢氧根离子的浓度是0.1mol/L,氢氧根离子的物质的量是0.05mol,根据得失电子守恒,所以电池中转移电子的物质的量是0.05mol,该燃料电池的能量利用率为80%,所以需要N2H4的质量为0.05mol/4×32g/mol/80%=0.5g。
2NaOH+H2↑+Cl2↑, 500mL的溶液的pH=13,则氢氧根离子的浓度是0.1mol/L,氢氧根离子的物质的量是0.05mol,根据得失电子守恒,所以电池中转移电子的物质的量是0.05mol,该燃料电池的能量利用率为80%,所以需要N2H4的质量为0.05mol/4×32g/mol/80%=0.5g。
考点:考查盖斯定律的应用,反应速率的计算,平衡状态的判断,电化学反应原理的应用
本题难度:困难
5、选择题 用石墨电极电解含有一定量重水(D2O)的水(H2O),下列说法正确的是
A.相同状况下两电极上产生的气体体积之比为2 :1
B.两电极上产生的气体质量之比为8 :1
C.相同状况下两电极上产生的气体体积之比为4 :1
D.若两电极上产生的气体质量比为16 :3,则D2O与H2O的物质的量之比为1 :1
参考答案:CD
本题解析:略
本题难度:简单