时间:2019-07-03 23:42:13
1、填空题 (14分)铅蓄电池是可充电型电池,它的正负极极板是惰性材料,电池总反应式为:?
Pb+PbO2+4H++2SO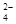
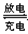 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):?
(1) 该蓄电池放电工作时的负极材料是?,用其电解氯化钠溶液,当阳极上收集到11.2L氯气时(标况下),理论上负极板的质量增加?g。
充电时,上图中A极应接直流电源的?(填“正极”或“负极”)。充电时A极的电极反应式是?;
(2) MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式 ? 。现以铅蓄电池为电源电解,当蓄电池中有0.4mol H+被消耗时,则电路中通过的电子的物质的量为?,MnO2的理论产量为 ? g。
参考答案:(1)铅?48,?正 ?PbSO4+2H2O-2e-= PbO2+4H++SO42-?(2)2H++2e-=H2?0.2mol? 8.7
本题解析:(1)根据电池的总反应可知,铅蓄电池放电时的负极发生氧化反应,所以负极材料为Pb,发生的电极反应为Pb-2e-+SO42-=PbSO4,因此负极增加的质量为SO42-的质量,用该电池电解氯化钠溶液时,当阳极上收集11.2L氯气时,转移1mol电子,所以负极增加48g。充电时,A极应发生氧化反应,所以与电源正极相连,电极反应为PbSO4+2H2O-2e-= PbO2+4H++SO42-。
(2)电解酸化的MnSO4溶液,阴极发生还原反应,电极反应为2H++2e-=H2。根据铅蓄电池的总反应可知,1molH2SO4参加反应转移1mol电子,所以0.4mol H+被消耗时,转移0.2mol 电子,生成MnO20.1mol,质量为8.7g。
点评:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,据此可以进行有关的判断。电解中最关键的是准确判断出电极上离子的放电顺序。在判断电解产物时,首先判断阳极电极材料。如果是活性电极,则电极本身失去电子。如果是惰性电极,则溶液中的阴离子失去电子。而阴极是溶液中的阳离子得到电子,所以需要熟练记住常见离子的放电顺序。
本题难度:一般
2、选择题 锂离子电池已经成为应用最广泛的可充电电池.某种锂离子电池的结构示意图:其中两极区间的隔膜只允许Li+通过.电池充电时的总反应化学方程式为:LiC002=Li1-xC002+xLi.关于该电池的推论错误的是( )
A.放电时,Li+主要从负极区通过隔膜移向正极区
B.放电时,负极反应xLi-xe-=xLi+
C.充电时,负极(C)上锂元素被氧化
D.充电时,有电能转化为化学能
参考答案:A、放电时,是原电池的工作原理,在原电池中,阳离子Li+移向正极,故A正确;
B、放电时,是原电池的工作原理,原电池的负极发生失电子的氧化反应,即xLi-xe-=xLi+,故B正确;
C、充电时,属于电解池的工作原理,电解池的阴极发生得电子的还原反应,即锂元素被还原,故C错误;
D、充电时,属于电解池的工作原理,电解池是将电能转化为化学能的装置,故D正确.
故选C.
本题解析:
本题难度:简单
3、选择题 氢氧燃料电池以氢气作还原剂,氧气作氧化剂,电极为多孔镍,电解质溶液为30%的氢氧化钾溶液。以下几种说法,正确的组合是( )
①正极反应为O2+4e-+4H+===2H2O ②负极反应为2H2+4OH--4e-===4H2O
③电池工作时正极区pH升高,负极区pH下降 ④电池工作时溶液中的阴离子移向正极
A.①②③
B.②③
C.②④
D.①④
参考答案:B
本题解析:在氢氧燃料电池中负极通入氢气,正极通入氧气,若电解质是碱性溶液,则负极和正极的电极反应式分别为2H2+4OH--4e-===4H2O、O2+4e-+2H2O+===4OH-。在原电池中阳离子向正极移动,阴离子向负极移动。所以正确的答案是B。
本题难度:一般
4、填空题 (共8分)新型高能钠?硫电池以熔融的钠、硫为电极,以导电的陶瓷为固体电解质。该电池放电时为原电池,充电时为电解池,反应原理为:2Na+xS Na2Sx。
Na2Sx。
(1)放电时Na发生________反应(填:氧化或还原),S作________极
(2)充电时Na所在电极与直流电源的________极相连。
(3)放电时负极反应为_______________________;
(4)用此电池作电源电解饱和NaCl溶液,当阳极产生33.6 L(标准状况)气体时,消耗金属Na的质量为______。
参考答案:(1)氧化 正 (2)负 (3)Na-e-=Na+ (4)69 g? (每小题2分)
本题解析:(1)放电相当于原电池,充电相当于电解池。原电池正负极失去电子,发生氧化反应,所以根据反应式可知钠是负极,发生氧化反应,硫是正极,发生还原反应。
(2)放电时正极发生还原反应,所以充电时就要发生氧化反应,因此充电时正极和电源的正极相连,负极和电源的负极相连。所以钠和电源的负极相连。
(3)负极失去电子,反应式为Na-e-=Na+。
(4)电解饱和NaCl溶液时,阳极氯离子放电,生成氯气,所以转移的电子是 ,因此根据得失电子守恒可知,需要钠的质量是3.0mol×23g/mol=69g。
,因此根据得失电子守恒可知,需要钠的质量是3.0mol×23g/mol=69g。
本题难度:一般
5、选择题 科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如下图所示,下列说法不正确的是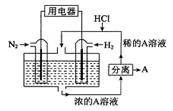
A.通入N2的电极发生的电极反应式为:N2 + 6e- + 8H+="=" 2NH4+
B.反应过程中溶液的pH会变大,故需要加入盐酸
C.该电池外电路电流从通入H2的电极流向通入N2的电极
D.通入H2的电极为负极,A为NH4Cl
参考答案:C
本题解析:A.该电池的本质是合成氨反应,所以正极是氮气发生还原反应,电极反应式为N2 + 6e- + 8H+=2NH4+,正确;B.反应过程中,H+不断消耗导致PH值变大,需要加入盐酸,正确;C.该装置是原电池装置,电流由正极通过外电路流向负极,即由通入氮气的电极沿外电路流向通入氢气的电极,错误;D.通入氢气的电极为负极,生成的铵根离子与氯化氢结合生成氯化铵,所以A是NH4Cl,正确;选C。
考点:考查新型燃料电池的工作原理。
本题难度:一般