时间:2019-07-03 23:42:13
1、简答题 有些化学反应的化学能能直接转化成电能
I.利用Fe+CuSO4=FeSO4+Cu反应,设计一个原电池:
(1)在右框中画出装置图(标明电解质溶液、正、负极和电极材料)
(2)下列说法中,正确的是______.(填字母)
A.电解质溶液中阳离子向负极移动?B.电子通过外导线由负极流向正极
C.当导线中有1mol电子通过时,理论上正极放出1g气体
D.若所选电极的质量相等,理论上两极质量差为60g,导线中有1mol电子通过
II.三套装置如图所示,A、B、C烧杯中分别盛有相同物质的量浓度的稀硫酸.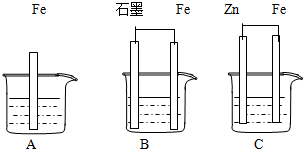
(1)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为______;
(2)若C中电解质溶液是氯化钠溶液,则Fe电极的电极反应式为______;
III.目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:Cd+2NiO(OH)+2H2O?
?2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸.
(1)以下说法中正确的是______①以上反应是可逆反应;?②以上反应不是可逆反应③充电时化学能转变为电能;④放电时化学能转变为电能.
(2)废弃的镍镉电池已成为重要的环境污染物,资料表明一节废镍镉电池可以使一平方米面积的耕地失去作用价值.在酸性土壤中这种污染特别严重,这是因为______
(3)另一种常用的电池是锂电池,锂是一种碱金属元素,其相对原子质量为7,由于它的比容量(单位质量电极材料所能转换的电量)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年,它的负极用金属锂制成,电池总反应可表示为Li+MnO2=LiMnO2.
锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液______(请用化学方程式表示其原因).
参考答案:I.(1)在Fe+CuSO4=FeSO4+Cu反应中,Fe被氧化,应为原电池的负极,正极为活泼性较Fe弱的金属或非金属,电解质为CuSO4溶液,可设计原电池为,故答案为: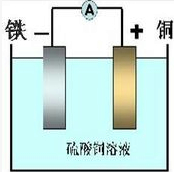
;
(2)A.电解质溶液中阳离子向正极移动,阴离子向负极移动,故A错误;
B.原电池工作时,电子从负极经外电路流向正极,故B正确;
C.正极反应为Cu2++2e-=Cu,无气体生成,故C错误;
D.当有1mol电子通过时,负极铁的质量减少为12mol×56g/mol=28g,正极析出铜的质量为12mol×64g/mol=32g,质量差为60g,故答案为:B、D;
II.(1)B中铁为负极,发生电化学腐蚀,A为化学腐蚀,C铁为原电池的正极,不易被腐蚀,所以腐蚀速率由快到慢的顺序为B、A、C,故答案为:B、A、C;?
(2)若C中电解质溶液是氯化钠溶液,发生吸氧腐蚀,正极反应为O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-;
III.(1)目前常用的镍(Ni)镉(Cd)电池,充电时是将电能转化为化学能,放电时将电能转化为化学能,为不同条件下的反应,不是可逆反应,故答案为:②④;
(2)Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,在酸性土壤中生成生成Ni2+?和Cd2+,导致污染特别严重,
故答案为:Ni(OH)2、Cd(OH)2可被酸溶解,生成Ni2+?和Cd2+;
(3)金属锂较活泼,易与水反应,反应的方程式为2Li+2H2O═2LiOH+H2↑,故答案为:2Li+2H2O═2LiOH+H2↑.
本题解析:
本题难度:一般
2、填空题 23.已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4 2PbSO4+2H2O
2PbSO4+2H2O
负极反应为:Cd+2OH--2e-=Cd(OH)2
铅蓄电池使用(放电)一段时间后,其内阻明显增大,电压却几乎不变,此时只有充电才能继续使用。镍镉碱性充电电池使用(放电)到后期,当电压明显下降时,其内阻却几乎不变,此时充电后也能继续使用。回答下列问题:
⑴铅蓄电池在放电时的负极反应为?,其在充电时阳极反应为?;
⑵镍镉碱性充电电池在充电时的总反应的化学方程式为?;
⑶上述两种电池使用一段时间后,一个内阻明显增大,而另一个内阻却几乎不变的主要原因可能是?;
⑷如果铅蓄电池在放电时回路中有2mol电子转移时,消耗H2SO4?mol。
参考答案:(1)Pb+SO42—-2e—=PbSO4? PbSO4+2H2O-2e—=PbO2+SO42—+4H+
(2)Cd(OH)2+2Ni(OH)2=Cd+2NiO(OH)+2H2O
(3)铅蓄电池放电时离子浓度减小,而镍镉电池放电时离子浓度不变
(4)2
本题解析:略
本题难度:一般
3、填空题 (14分)运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)某硝酸厂处理尾气中NO的方法是:催化剂存在时用H2将NO还原为N2。已知: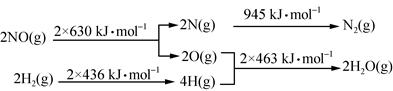
则氮气和水蒸气反应生成氢气和一氧化氮的热化学方程式是 。
(2)在压强为0.1 Mpa条件,将a mol CO和3a mol H2的混合气体在催化剂作用下转化为甲醇的反应如下:CO(g)+2H2(g) CH3OH(g) ΔH<0。
CH3OH(g) ΔH<0。
①该反应的平衡常数表达式为________________。
②若容器容积不变,下列措施可增大甲醇产率的是________。
A.升高温度
B.将CH3OH从体系中分离
C.充入He,使体系总压强增大
(3)某研究小组在实验室研究某催化剂效果时,测得NO转化为N2的转化率随温度变化情况如图。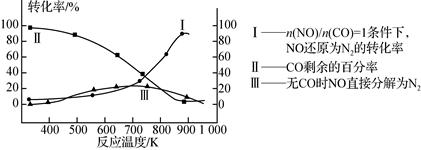
①若不使用CO,温度超过775 ℃,发现NO的分解率降低,其可能的原因为________;在n(NO)/n(CO)=1的条件下,应控制最佳温度在________左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染。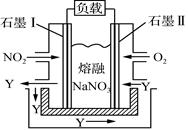
写出C2H6与NO2发生反应的化学方程式________________。
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,则该电极反应式为________________________。
参考答案:(1)N2(g)+2H2O(g)===2NO(g)+2H2(g) ΔH=+665 kJ·mol-1
(2)c(CH3OH)/c(CO)·c2(H2);B
(3)①该反应是放热反应,升高温度反应更有利于向逆反应方向进行;870℃
②4C2H6+14NO2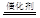 8CO2+7N2+12H2O
8CO2+7N2+12H2O
(4)NO2+NO3--e-===N2O5
本题解析:(1)化学反应方程式为N2+2H2O===2NO+2H2,由图 可知,ΔH=945+4×463-2×630-2×436=+665 kJ·mol-1,故热化学方程式为N2(g)+2H2O(g)===2NO(g)+2H2(g) ΔH=+665 kJ·mol-1;
可知,ΔH=945+4×463-2×630-2×436=+665 kJ·mol-1,故热化学方程式为N2(g)+2H2O(g)===2NO(g)+2H2(g) ΔH=+665 kJ·mol-1;
(2)由热化学方程式CO(g)+2H2(g) CH3OH(g) ΔH<0可知,平衡常数K=
CH3OH(g) ΔH<0可知,平衡常数K=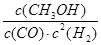 ;欲增大甲醇产率,则应使该平衡正向移动,升高温度,平衡向着吸热的方向移动,该平衡逆移, 将CH3OH从体系中分离,可使平衡正移,充入He,使体系总压强增大,该平衡不移动,故选择B;
;欲增大甲醇产率,则应使该平衡正向移动,升高温度,平衡向着吸热的方向移动,该平衡逆移, 将CH3OH从体系中分离,可使平衡正移,充入He,使体系总压强增大,该平衡不移动,故选择B;
(3)①由图可知,若不使用CO,温度超过775 ℃,发现NO的分解率降低,则该反应是放热反应,升高温度反应更有利于向逆反应方向进行;在n(NO)/n(CO)=1的条件下,应控制最佳温度在850-900℃之间;
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染,C2H6与NO2反应,生成无污染的N2和CO2,反应方程式为4C2H6+14NO2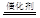 8CO2+7N2+12H2O;
8CO2+7N2+12H2O;
(4)以NO2、O2、熔融NaNO3组成的燃料电池,由图可知,石墨Ⅰ为燃料电池的负极,负极失电子,生成一种氧化物Y,电极反应为NO2+NO3--e-===N2O5。
考点:热化学方程式的书写,平衡常数的计算,化学平衡的移动,图像的描述,化学反应方程式的书写,电极反应的书写
本题难度:困难
4、填空题 (16分)NH3能被O2氧化生成NO,进而氧化成NO2,用来制造硝酸;将NO2(g)转化为N2O4(l),再制备浓硝酸。
(1)2NO(g)+ O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率的不同压强(P1、P2)下随温度变化的曲线如图。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率的不同压强(P1、P2)下随温度变化的曲线如图。
①P1______(填“>”或“<”)P2
②随温度升高,该反应平衡常数变化的趋势是____________。
(2)已2NO2(g) N2O4(g) △H1<0
N2O4(g) △H1<0
2NO2(g) N2O4(l) △H2<0
N2O4(l) △H2<0
下列能量变化示意图中,正确的是_______(填序号)
(3)50℃时在容积为1.0L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随着反应的进行,混合气体的颜色变深。达到平衡后,改变反应 温度T,10s后又达到平衡,这段时间内,c(N2O4)以0.0020mol/(L·s)的平均速率降低。
2NO2(g),随着反应的进行,混合气体的颜色变深。达到平衡后,改变反应 温度T,10s后又达到平衡,这段时间内,c(N2O4)以0.0020mol/(L·s)的平均速率降低。
①50℃时,体系中各物质浓度随时间变化如图所示。在0~60s 时段,反应速率v(NO2)为_________mol/(L·s)。
②T______(填“>”或“<”) 50℃。
③计算温度T时该反应的平衡常数K(写出计算过程)。
(4)科学家正在开发以氨代替氢气的新型燃料电池有许多优点;制氨工业基础好、技术成熟、成本低、储运方便等。直接供氨式碱性(KOH)燃料电池的总反应为:4NH3+3O2==2N2+6H2O,氨气应通入_______(填“正极”或“负极”)室,正极反应式为_____________________________
参考答案:(1)① <(1分) ②逐渐减小(1 分) (2)A(2分)
(3)① 0.0020(2分) ②>(2分)
③反应达平衡时N2O4的浓度减少0.0020 mol/(L·s) ×10s=0.020 mol/L(1分)
N2O4(g)  2NO2(g)
2NO2(g)
c开始(mol/L) 0.040 0.12
c平衡(mol/L) (0.040-0.020)(0.12+0.020×2)(2分)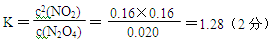
(4)负极(1分) 3O2+ 6H2O + 12e-=12OH-(2分)
本题解析:(1)①反应是气体体积减少的反应,温度相同时压强越大,平衡向正向移动,NO的转化率就越大,P2下的转化率比P1大,故P2较大,则P1<P2,②压强相等时,温度升高NO的转化率减小。故升高温度平衡向逆向移动,平衡常数减小。(2)反应的△H<0,所以反应是放热反应,NO2的能量较高,同种物质气态的能量比液态高,故A对。(3)①从图看出0~60s 时段,NO2的浓度改变了0.12mol/L,则NO2反应速率为:0.12mol/L÷60s=" 0.0020" mol/(L·s)。 ②2NO2(g) N2O4(g) △H<0则N2O4(g)
N2O4(g) △H<0则N2O4(g) 2NO2(g),是吸热反应,改变温度后NO2(g)的浓度增大,故平衡向正向移动,所以是升高温度,则T>50℃。③反应达平衡时N2O4的浓度减少0.0020mol/(L·s) ×10s=0.020mol/L(1分)
2NO2(g),是吸热反应,改变温度后NO2(g)的浓度增大,故平衡向正向移动,所以是升高温度,则T>50℃。③反应达平衡时N2O4的浓度减少0.0020mol/(L·s) ×10s=0.020mol/L(1分)
N2O4(g)  2NO2(g)
2NO2(g)
c开始(mol/L) 0.040 0.12
c平衡(mol/L) (0.040-0.020)(0.12+0.020×2)(2分)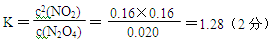
(4)从反应方程式看出N 的化合价升高,失去电子,故在负极反应;NH3在负极反应,那么O2在正极反应,电解质溶液是碱性的,电极反应为:3O2+ 6H2O + 12e-=12OH-(2分)
考点:化学平衡图像、化学平衡的移动、化学平衡常数的计算、燃料电池的工作原理。
本题难度:困难
5、选择题 燃料电池是燃料(如CO、H2、CH4等)跟O2(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱(如KOH)溶液,下列关于甲烷燃料电池的说法中不正确的是( )
A.通入氧气的一极发生还原反应,通入甲烷的一极发生氧化反应
B.负极的电极反应式为CH4+10OH--8e-═CO
参考答案:A、通入氧气的一极发生还原反应,通入甲烷的一极发生氧化反应,故A正确;
B、正极反应为O2+2H2O+4e-=4OH-;总化学方程式为:CH4+2O2+2OH-=CO32-+3H2O;总反应减去正极反应得到负极的电极反应式为:CH4+10OH--8e-═CO?2-3+7H2O;故B正确;
C、随着不断放电,原电池反应中反应生成水,氢氧根离子浓度减小,电解质溶液的pH减小,故C错误;
D、甲烷燃料电池实现化学能转化为电能,电池反应的能量利用率比甲烷燃烧的大,故D正确;
故选C.
本题解析:
本题难度:简单