时间:2019-07-03 23:38:43
1、选择题 常温下,将0.1 mo1·L一1的醋酸溶液加水稀释至原来体积的10倍,下列有关叙述正确的是
A.CH3 COOH的电离平衡常数增大为原来的10倍
B.CH3 COO一与CH3 COOH的浓度之比增大为原来的10倍
C.CH3 COO一与H十的浓度之积减小为原来的0.1
D.CH3 COOH与CH3 COO—的浓度之和减小为原来的0.1
参考答案:D
本题解析:A、醋酸的电离平衡常数只与温度有关,温度不变,醋酸的电离平衡常数不变,故A错误;B、加水稀释醋酸,促进醋酸电离,醋酸跟离子的物质的量增大,醋酸分子的物质的量减小,但醋酸是弱电解质不能完全电离,使CH3 COO一与CH3 COOH的浓度之比小于原来的10倍,故B错误;C、醋酸是弱电解质不能完全电离,稀释后浓度之积小于原来的0.1;D、溶液中CH3COOH与CH3COO—的物质的量的和没有变化,溶液体积增加后浓度之和减小为原来的0.1,故D正确。
本题难度:一般
2、填空题 (1)某温度下纯水的c(H+)=2.0×10-7mol/L。在此温度下,某溶液中由水电离出的c(H+)为4.0× 10-13 mol/L,则该溶液的pH可能是____。
(2)分别将少量CO2气体通入一元酸的钠盐NaA和NaB的溶液中,发生的反应为:
①CO2+2NaA+ H2O==Na2CO3+2HA;
②CO2+NaB+H2O==NaHCO3+HB,
试由此推断H2CO3、HCO3-、HA、HB 的电离程度由大到小顺序为___。
(3)已知在相同条件下,HCN的电离程度比HF小。请根据有关知识分析判断,在相同温度下,物质的量浓 度相同的NaCN溶液和NaF溶液中: [c(CN-)+c(OH-)]____[f(F-)+c(OH-)]
(选填“等于”、“大于”或“小于”)。
参考答案:(1)1或 12.4(即l3-lg4)
(2)H2CO3>HB>HCO3->HA
(3)等于
本题解析:
本题难度:一般
3、选择题 下列电离方程式中,书写正确的是? (? )
A.Cu(OH)2=Cu2+ + 2 OH-
B.NH3·H2O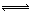 NH4+ + OH-
NH4+ + OH-
C.HF= H+ + F-
D.H3PO4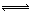 3 H+ + PO43-
3 H+ + PO43-
参考答案:B
本题解析:氢氧化铜、HF是弱电解质,应该用可逆号,所以A、C都不正确;磷酸是三元酸,电离是分步进行的,D不正确,所以正确的答案选B。
本题难度:一般
4、填空题 常温下,有浓度均为0.1 mol/L的4种溶液:①盐酸;②硫酸;③醋酸;④氢氧化钡。(注:忽略溶液混合时 体积的变化)
(1)将上述溶液两两等体积混合后,溶液pH=7的组合有(填序号)_________。
(2)醋酸钡是易溶于水的强电解质。将③与④等体积混合,所得溶液中离子浓度由大到小的顺序是_____。
参考答案:(1)②和④
(2)c(OH-)>c(Ba2+)>c(CH3COO-)>c(H+)
本题解析:
本题难度:一般
5、填空题 某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:常温下将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1 mL,分别加水稀释到1 000 mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题: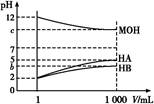
(1)HA为?酸,HB为?酸(填“强”或“弱”)。
(2)若c=9,则稀释后的三种溶液中,由水电离的氢离子浓度的大小顺序为?(用酸、碱化学式表示)。
(3)若c=9,将稀释后的HA溶液和MOH溶液取等体积混合,则所得溶液中c(A-)与c(M+)的大小关系为c(A-)?(填“大于”、“小于”或“等于”)c(M+)。
(4)若b+c=14,则MOH为?碱(填“强”或“弱”)。将稀释后的HB溶液和MOH溶液取等体积混合,所得混合溶液的pH?7(填“大于”、“小于”或“等于”)。
参考答案:(1)强?弱? (2)MOH=HA>HB
(3)等于? (4)弱?等于
本题解析:(1)pH相同的两种酸稀释相同的倍数,弱酸的pH变化小,由图可知pH=2的酸溶液稀释1 000倍,HA的pH=5,则HA是强酸,而HB溶液稀释后pH<5,则HB是弱酸。
(2)若c=9,则MOH是强碱,则溶液中由水电离出的c(H+)=10-9 mol/L,而HA溶液pH=5,c(H+)=10-5 mol/L,则c(OH-)=c(H+)水电离=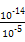 ?mol/L=10-9 mol/L,因HB溶液pH<5,则c(H+)>10-5 mol·L-1,溶液中水电离出的
?mol/L=10-9 mol/L,因HB溶液pH<5,则c(H+)>10-5 mol·L-1,溶液中水电离出的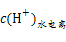 =c(OH-)<10-9 mol/L,则由水电离的c(H+)大小顺序为MOH=HA>HB。
=c(OH-)<10-9 mol/L,则由水电离的c(H+)大小顺序为MOH=HA>HB。
(3)若c=9,相当于强酸HA溶液和强碱MOH溶液等体积等浓度混合,两者恰好完全反应,则pH=7,即c(H+)=c(OH-),再根据电荷守恒可知,c(H+)+c(M+)=c(OH-)+c(A-)可得出c(A-)=c(M+)。
(4)若b+c=14,而b<5,则c>9,可判断MOH为弱碱,又因稀释前HB溶液中c(H+)=10-2 mol·L-1,稀释后HB溶液中c(H+)=10-b mol·L-1,而稀释前MOH溶液中c(OH-)=10-2 mol·L-1,稀释后MOH溶液中c(OH-)=10-14+c mol·L-1=10-b mol·L-1,故两者稀释前后,c(H+)与c(OH-)分别对应相等,据此可知:HB与MOH的强弱相当,故两溶液混合相当于等体积等浓度等电离程度的HB与MOH混合,两者恰好完全反应生成MB,且M+与B-的水解程度相同,故所得混合溶液pH=7。
本题难度:一般