时间:2019-07-03 23:32:52
1、选择题 用NA表示阿伏加德罗常数,64gSO2含有氧原子数为( )
A.1NA
B.2NA
C.3NA
D.4NA
参考答案:B
本题解析:64gSO2的物质的量是64g/64g/mol=1mol,1个二氧化硫分子中含有2个O原子,所以所含O原子总数是2NA,答案选B
考点:考查阿伏伽德罗常数的计算
本题难度:一般
2、选择题 下列叙述中正确的是(? )
A.标准状况下,2.24L CHCl3含有的分子数为0.1NA
B.1.8 g 的NH4+离子中含有的电子数为NA
C.常温常压下,48g O3含有的氧原子数为NA
D.0.1mol CnH2n+2中含有的碳碳单键数为0.1n NA
参考答案:B
本题解析:A中物质在标准状况下不是气体,不正确。1.8 g 的NH4+离子是0.1mol,含有电子是0.1mol×10=1mol,B正确。48g O3的物质的量是48g÷48G/MOL=1mol,含有氧原子是1mol×3=3mol,C不正确。D中氢原子和碳原子全部形成单键,共2n+2个,碳原子个碳原子形成的单键是n-1个,所以单键共有2n+2+n-1=3n+1个,D不正确,答案选B。
本题难度:一般
3、选择题 用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.0.1 mol Fe在0.1mol CL2中充分燃烧,转移的电子数为0.3NA
B.标准状况下,11.2 L CCl4所含分子数约为0.5NA
C.常温下,pH=13的NaOH溶液中,OH-的数目为0.1NA
D.常温、常压下,14g CO与N2的混合气含的原子数为NA
参考答案:D
本题解析:A、0.1 mol Fe在0.1mol CL2中充分燃烧生成氯化铁,铁过量,所以转移的电子数为0.2NA,A不正确;B、标准状况下四氯化碳不是气体,不能适用于气体摩尔体积,即标准状况下,11.2 L CCl4的物质的量不是0.5mol,B不正确;C、常温下,pH=13的NaOH溶液中,OH-的物质的量浓度是0.1mol/L,氮溶液的体积不能确定,所以无法计算氢氧化钠的物质的量,C不正确;D、CO和氮气相对分子质量均是28,且均是双原子分子,所以常温、常压下,14g CO与N2的混合气的物质的量是0.5mol,所含的原子数为NA,D正确,答案选D。
本题难度:一般
4、选择题 由H2与CO组成的混合气体1.5 g,在标准状况下其体积为2.24 L则混合气体中H2、CO的质量比为(? )
A.1∶1
B.14∶1
C.1∶14
D.1∶7
参考答案:C
本题解析:混合气体的平均摩尔质量为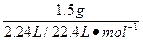 ="15" g·mol-1
="15" g·mol-1
用十字交叉法: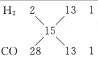 ,即H2、CO的物质的量之比为1∶1,故质量比为2∶28=1∶14。
,即H2、CO的物质的量之比为1∶1,故质量比为2∶28=1∶14。
本题难度:简单
5、选择题 用NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.22.4 L氢气中含有2NA个氢原子
B.14 g氮气中含NA个氮原子
C.2L 0.30mol/L Na2SO4溶液中所含0.6NA个Na+
D.标准状况下,含有NA个氧原子的臭氧(O3)体积约为11.2L
参考答案:B
本题解析:未指明是标准状况下的体积,A错误;14g氮气中含有1mol氮原子,故含NA个氮原子 B正确;2L 0.30mol/L Na2SO4溶液中所含钠离子的物质的量为1.2mol,C错误;标准状况下,含有NA个氧原子的臭氧的物质的量为1/3,故体积为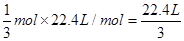 ,D错误;答案选B
,D错误;答案选B
考点:物质的量的计算
本题难度:一般