时间:2019-07-03 23:29:36
1、选择题 实验室现有3种酸碱指示剂,其pH变色范围如下:甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0用0.1000 mol·L-1 NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是
[? ]
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
参考答案:D
本题解析:
本题难度:一般
2、选择题 用滴定法测定Na2CO3(含NaCl杂质)的质量分数,下列操作会引起测定值偏高的是?
[? ]
A.试样中加入酚酞作指示剂,用标准酸液进行滴定 ?
B.滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定?
C.锥形瓶用蒸馏水洗涤后,直接加入待测溶液进行滴定 ?
D.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00?mL进行滴定
参考答案:B
本题解析:
本题难度:简单
3、选择题 下列有关实验原理或实验操作结论正确的是 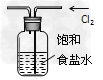
[? ]
A.?配制酸性KMnO4溶液时,用盐酸酸化
B.?用水湿润pH试纸测量某溶液的pH值
C.?实验室用上图所示装置除去Cl2中的少量HCl
D.?用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列有关中和滴定的操作:
①用标准液润洗滴定管;
②往滴定管内注入标准溶液;
③检查滴定管是否漏水;
④滴定;
⑤滴加指示剂于待测液;
⑥洗涤。
正确的操作顺序是
[? ]
A.③⑥①②⑤④
B.⑤①②⑥④③
C.⑤④③②①⑥
D.③①②④⑤⑥
参考答案:A
本题解析:
本题难度:简单
5、简答题 某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下两步操作:
第一步:配制500ml?烧碱样品溶液.
(1)检查容量瓶是否漏液的方法是:往瓶内加入一定量水,塞好瓶塞.______
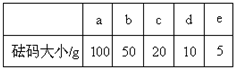
(2)用质量为13.1g的空烧杯,需要称取烧碱样品20g.则放在托盘天平上称取时,最终选取所需的砝码为______(填附表中的字母),并在下图中选出能正确表示游码位置的选项______(填字母).
附表:砝码规格?
?
?
?附:游码位置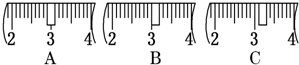
(3)配制溶液的操作步骤如下图的乙图所示,则甲图操作应在乙图中的______(填选项字母)之间.
A、①与②B、②与③C、③与④D、④与⑤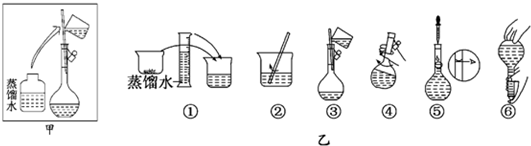
第二步:中和滴定,以确定烧碱样品的纯度.
A.用碱式滴定管量取25.00mL烧碱溶液于锥形瓶中,并滴入几滴酚酞作指示剂
B.将浓度为c?mol/L的硫酸标准溶液装入润洗好的酸式滴定管中,调节液面使开始读数为V1?mL
C.在锥形瓶下垫一张白纸,滴定至终点时,记下读数为V2?mL
试填空:
(1)滴定至终点的判定标准是:当加入最后一滴硫酸溶液时,溶液的颜色由______色变为______色.
(2)C步骤的操作中,锥形瓶下垫一张白纸的作用是______
(3)该烧碱样品纯度为______.
参考答案:第一步:(1)容量瓶检漏的方法:往瓶内加入一定量水,塞好瓶塞,用食指摁住瓶塞,另一只手托住瓶底,把瓶倒立过来,观察瓶塞周围是否有水漏出.如果不漏水,将瓶正立,并将瓶塞旋转180°后塞紧,仍把瓶倒立过来,再检查是否有水漏出.如果不漏水,则可以使用,
故答案为:用食指摁住瓶塞,另一只手托住瓶底,把瓶倒立过来,观察瓶塞周围是否有水漏出.如果不漏水,将瓶正立,并将瓶塞旋转180°后塞紧,仍把瓶倒立过来,再检查是否有水漏出.如果不漏水,则可以使用;?
(2)托盘天平称量药品的原理是:左盘质量等于右盘质量+游码质量,当天平平衡时,左盘空烧杯和烧碱样品的总质量为33.1g,m(砝码)+m(游码=m(样品)=33.1g,砝码的质量为30g,游码的质量为0.1g,故答案为:c、d;C;?
(3)根据实验操作的步骤有:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,定容在转移洗涤液摇匀之后完成,故选:D;
第二步:(1)因烧碱溶液使酚酞变红,氯化钠溶液不能使酚酞变红,当烧碱溶液恰好全部转变为氯化钠,溶液颜色由浅红色变为无色,故答案为:浅红;无;
?(2)因锥形瓶下垫一张白纸使滴定终点颜色变化更明显,便于分辨,故答案为:使滴定终点颜色变化更明显,便于分辨;
(3)25.00mL烧碱消耗的硫酸标准溶液的物质的量为:c(V2-V1?)×10-3mol,
? 利用关系式:H2SO4 ~2NaOH
? c(V2-V1?)×10-3mol? 2×c(V2-V1?)×10-3mol
则500ml?烧碱样品溶液烧碱的物质的量2×c(V2-V1?)×10-3mol×20,其质量为:2×c(V2-V1?)×10-3mol×20×40g/mol=1.6×c(V2-V1?)g,
烧碱样品纯度为1.6×c(V2-V1?)g20g×100%=8?c(V2-V1?)%,故答案为:8?c(V2-V1?)%.
本题解析:
本题难度:一般