时间:2019-07-03 23:29:36
1、填空题 I.如图1为向25mL 0.1mol·L-1 NaOH溶液中逐滴滴加0.2mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。请回答: 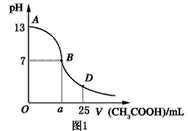
(1)?B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?________(选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?________区间(若正确,此问不答)。?
(2) 关于该滴定实验,从下列选项中选出最恰当的一项________(选填字母)。
?  ?
? 
(3)?AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是________。
A.c(OH-)大于c(CH3COO-)
B.c(OH-)小于c(CH3COO-)
C.c(OH-)等于c(CH3COO-)
D.上述三种情况都可以
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH)________2c(Na+)(填“>”“<”或“=”)。
Ⅱ.t℃时,某稀硫酸溶液中c(H+) = 10-a mol·L-1,c(OH-) = 10-b mol·L-1,已知 a+b=13
(5)该温度下水的离子积常数Kw的数值为________。
(6)该温度下(t℃),将100mL 0.1mol·L-1的稀H2SO4与100mL 0.4mol·L-1的NaOH溶液混合(溶液体积变化忽略不计),溶液的pH=________。
参考答案:(1) 否; AB
(2)D
(3)D
(4)=
(5)1×10-13
(6)12
本题解析:
本题难度:一般
2、填空题 某化学小组为测定加碘盐中KIO3的质量分数并制备少量KIO3,进行了如下实验.
I.测定加碘盐中KIO3的质量分数(杂质不发生反应)
已知:KIO3+3H2SO4+5KI=3I2+3K2CO3+3H2O;?I2+2Na2S2O3=2Na?I+Na?2S4O6
步骤一:准确称取a?g加碘盐,配制成250mL溶液;
步骤二:取所配溶液25.00mL于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液;
步骤三:以淀粉为指示剂,用c?mol?L-1的Na2S2O3溶液滴定步骤二所得溶液至终点,记录数据;重复滴定2次,平均消耗Na2S2O3溶液12.00mL.
(1)步骤一中配制250mL溶液用到的玻璃仪器除烧杯、玻璃棒和量筒外,还有______.
(2)步骤三中到达滴定终点时的现象为______.
(3)实验测得此加碘盐中KIO3的质量分数=______(KIO3的相对分子质量为214).
II.实验室制备KIO3
已知:碘酸盐可以用氯气在碱性溶液中氧化碘化物得到.
该化学小组通过以下装置制备KIO3.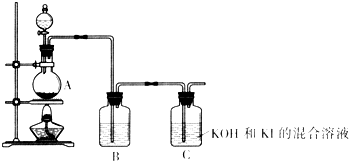
(4)装置A中反应的离子方程式为______.
(5)装置B中的试剂为______.
(6)写出装置C中生成KIO3的离子方程式______.
(7)上述实验装置存在一处明显缺陷,请指出______.
参考答案:Ⅰ、(1)配制250mL溶液用到的仪器有托盘天平、药匙、玻璃棒、烧杯、250mL容量瓶、量筒(可用可不用),故还需要的玻璃仪器有:250mL容量瓶,
故答案为:250mL容量瓶;
(2)步骤二中生成I2,加入淀粉,溶液呈蓝色,用Na2S2O3溶液滴定,I2反应完毕,溶液蓝色褪色,故答案为:溶液蓝色褪色;
(3)25mL溶液消耗Na2S2O3的物质的量为c?mol?L-1×0.012L=0.012mol,故250mL溶液应消耗Na2S2O3的物质的量为0.012cmol×10=0.12cmol,令250mL溶液中KIO3的物质的量为xmol,则:
KIO3~~~~3I2~~~~6Na2S2O3
1? 6
xmol? 0.12cmol
所以x=0.02c
故加碘盐中KIO3的质量分数0.02cmol×214g/molag×100%=428ca%,
故答案为:428ca%;
Ⅱ、(4)由题目信息可知,氯气在碱性溶液中氧化碘化物得到碘酸盐,由装置图可知,装置A为制备氯气,加热制备氯气,实验室通常用二氧化锰与浓盐酸加热反应生成氯化锰、氯气与水制备,装置A的反应离子方程式为MnO2+4H++2Cl-?△?.?Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-?△?.?Mn2++Cl2↑+2H2O;
(5)浓盐酸具有挥发性,制备的氯气中含有HCl,影响C装置中的反应,装置B吸收HCl将其除去,通常用饱和食盐水吸收HCl,降低氯气的溶解,
故答案为:饱和食盐水;
(6)由题目信息可知,氯气在碱性溶液中氧化碘化物得到碘酸盐,故装置C中发生反应为氯气在碱性条件下氧化I-,生成氯离子、碘酸根与水,反应离子方程式为3Cl2+I-+6OH-=6Cl-+IO3-+3H2O,故答案为:3Cl2+I-+6OH-=6Cl-+IO3-+3H2O;
(7)由于氯气有毒,直接排放到大气中,会污染大气,应在C之后添加尾气吸收装置,吸收氯气,防止污染大气,故答案为:缺少吸收氯气的尾气吸收装置.
本题解析:
本题难度:一般
3、填空题 现有常温条件下的甲、乙、丙三种溶液。甲为0.1mol·L-1的NaOH溶液,乙为 0.1mol·L-1的HCl溶液,丙为0.1mol·L-1的CH3COOH溶液,试回答下列问题
(1)乙溶液中,由水电离出的c(H+)=____________ mol·L-1;
(2)丙溶液中存在的电离平衡为________________________________(用电离平衡方程式表示);
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为____________;
(4)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题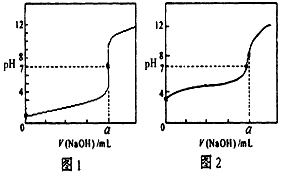
①甲溶液滴定丙溶液的曲线是_____________(填“图1”或“图2”);
②a=____________mL。
参考答案:(1)10-13?
(2)CH3COOH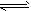 CH3COO-+H+, H2O
CH3COO-+H+, H2O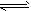 OH-+H+
OH-+H+
(3)丙>甲=乙
(4)①图2;②20.00
本题解析:
本题难度:困难
4、选择题 在化学实验操作中,往往由于读数不规范导致较大的实验误差.下列有关实验中,会导致所配制(或所测定)溶液浓度偏大的是(其他操作均正确)( )
A.配制500mL?1mol/L稀硫酸实验中,用量筒量取18.1mol/L浓硫酸时俯视读数
B.配制1mL?5.1mol/L氯化钠溶液实验中,定容时仰视
C.用标准盐酸滴定特测NaOH溶液实验中,使用碱式滴定管开始平视,后来俯视读数
D.用标准NaOH溶液滴定特测盐酸实验中,使用碱式滴定管开始平视,后来俯视读数
参考答案:C
本题解析:
本题难度:简单
5、填空题 ①制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。
②用NaOH测定滤液的浓度:准确称量1.000gNaOH固体质量,配制成250mL溶液,准确量取25.00mL溶液装在碱式滴定管,滴加2滴酚酞作指示剂。把滤液装在酸式滴定管中,调节液面排除气泡后,滤液的凹液面刚好在“0”刻度,滴定NaOH溶液,达到终点记录读数。实验重复3次。记录见下表。 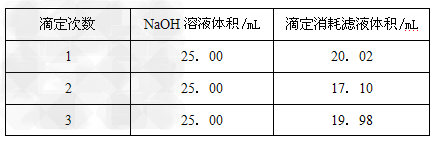
请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为_______________________________。
(2)?配制成250mL溶液使用的量具是__________,指示剂还可用____________;
(3)?滴定终点的现象是_______________________。
(4)?滤液中溶质的物质的量浓度为_____________。
(5)?若在滴定终点读取滴定管刻度时,俯视标准液液面,使对测定结果________。?(填“偏高”、“偏低”或“无影响”)
参考答案:(1)TiCl4+(x+2)H2O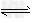 TiO2·xH2O↓+4HCl
TiO2·xH2O↓+4HCl
(2)?250mL容量瓶;甲基橙
(3)浅红色溶液变为无色,30秒内不褪色
(4)0.1250?mol·L-1
本题解析:
本题难度:一般