时间:2019-07-03 23:24:05
1、选择题 用惰性电极电解一定量的CuSO4溶液,下列说法中,正确的是
[? ]
参考答案:D
本题解析:
本题难度:一般
2、实验题 工业上以黄铜矿为原料,采用火法熔炼工艺生产粗钢。
(1)该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,反应的氧化剂是?。
6Cu+SO2↑,反应的氧化剂是?。
(2)火法熔炼的粗铜含杂质较多。某化学研究性学习小组在实验室条件下用CuSO4溶液作电解液来实现粗铜的提纯,并对电解后溶液进行净化除杂和含量测定。
实验一 粗铜的提纯粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应),电解时粗铜应与电源的?极相连,阴极上的电极反应式为?。
实验二 电解后溶液的净化除杂在精炼铜的过程中,电解液中c(Cu2+)逐渐下降,c(Fe2+)、c(Zn2+)会逐渐增大,所以需定时除去其中的Fe2+、Zn2+。甲同学参考下表的数据,设计了如下方案:
试剂a是?(填化学式),其目的是?;该方案能够除去的杂质离子是?(填离子符号)。
实验三 电解后溶液离子含量的测 定
乙同学设计了如下方案:
则100mL溶液中Cu2+的浓度为?mol·L-1,Fe2+的浓度为?mol·L-1。
参考答案:(14分)
(1)Cu2O 、Cu2S (2分);
(2)正(1分) Cu2++2e-= Cu(2分) H2O2(2分)将Fe2+氧化成Fe3+(2分) Fe2+ (2分)
0.75(2分)0.05(2分)
本题解析:
(1)反应中Cu2O 、Cu2S的Cu均从+1→0价,所以反应的氧化剂Cu2O 、Cu2S。
(2)精炼铜时粗铜做阳极与电源的正极相连,电极反应:Cu2++2e-= Cu。根据流程中调节pH到4可知三价铁沉淀,试剂a是氧化剂,将Fe2+氧化成Fe3+,除去Fe2+。固体为铁和铜的混合物,酸处理后的4.8g为铜,n(Cu)=4.8/64g/mol=0.075mol,c(Cu2+)=0.75 mol·L-1;根据题意生成m(Fe2O3)=6.4g,n(Fe2O3)=6.4g/160g/mol=0.04mol,得n(Fe)=0.08mol;其中来自与硫酸铜的置换反应的为0.075mol,所以原溶液中n(Fe)=0.005mol,Fe2+的浓度为0.05 mol·L-1。
本题难度:困难
3、填空题 (13分)氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 | 大气固氮 N2 (g)+O2 (g)  2NO(g) 2NO(g) | 工业固氮 N2 (g)+3H2 (g)  2NH3(g) 2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
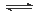 4NH3(g)+3O2(g),则其反应热ΔH=___________________。
4NH3(g)+3O2(g),则其反应热ΔH=___________________。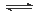 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1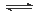 2H2O(l) △H=-571.6kJ·mol-1 )
2H2O(l) △H=-571.6kJ·mol-1 ) 参考答案:(1)①吸热(1分)
②K值小,正向进行的程度小(或转化率低),不适合大规模生产
③从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适
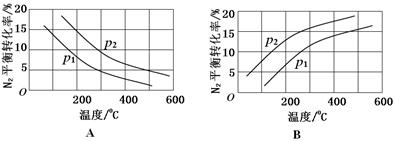
(2)A р2>р1
(3)N2+6e-+6H+ 2NH3
2NH3
(4)+1530 kJ·mol-1
本题解析:本题以氮的固定为背景考查原理性知识,通过K随温度的变化判断,大气固氮为吸热反应,而且270C时K值太小,化学反应进行的程度小,不适合大规模生产;人工固氮选择5000C左右,因为考虑到催化剂的活性;分析工业固氮的K随温度变化,确定为放热过程,所以A图正确,正反应为气体体积减小的反应,所以压强大N2的转化率高,所以р2>р1;利用电化学反应制取氨气,通入的氮气发生还原反应,且介质为酸性,从而写出电极反应式:N2+6e-+6H+ 2NH3;2N2(g)+6H2O(1)
2NH3;2N2(g)+6H2O(1)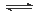 4NH3(g)+3O2(g)可以由反应[(1)×2-(2)×3]得到,根据盖斯定律确定其ΔH=+1530kJ/mol.
4NH3(g)+3O2(g)可以由反应[(1)×2-(2)×3]得到,根据盖斯定律确定其ΔH=+1530kJ/mol.
考点:平衡常数的应用、化学平衡图像、原电池电极反应式的书写、盖斯定律。
本题难度:困难
4、简答题 钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.V2O5是接触法制硫酸的催化剂.
(1)一定条件下,SO2?与空气反应t?min后,SO2?和SO3物质的量浓度分别为a?mol/L、b?mol/L,则SO2?起始物质的量浓度为______mol/L;生成SO3的化学反应速率为______.
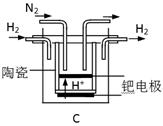
(2)全钒液流储能电池是利用不同价态离子对,发生氧化还原反应来实现化学能和电能相互转化的,其装置原理如图:
①当左槽溶液逐渐由黄变蓝,其电极反应式为______.
②充电过程中,右槽溶液颜色逐渐由______色变为______色.
③充电时若转移的电子数为3.01×1024个,左槽溶液中n(H+)的变化量为______?mol.
参考答案:(1)2SO2+O2 催化剂.△?2SO3
? 始:x? 0
? 转:b? b
? 平:a? b
x-b=a,x=a+b,故x=a+b,
v(SO3)=ct=b?mol/Lt?min=b?t?mol/(L?min)
故答案为:a+b;b?t?mol/(L?min);
(2)①当左槽溶液逐渐由黄变蓝,其电极反应式为VO2++2H++e-=VO2++H2O,说明此时为原电池,且为原电池的正极.
故答案为:VO2++2H++e-=VO2++H2O;
②充电过程中,右槽连接的是电源负极,为电解池的阴极,电极反应式为V3++e-=V2+,V3+为绿色,V2+为紫色,
故可以看到右槽溶液颜色逐渐由绿色变为紫色.
故答案为:绿;紫;
③充电时,左槽发生的反应为VO2++H2O=VO2++2H++e-,当转移电子为3.01×1024个即为5 mol电子时,生成氢离子为10 mol,此时氢离子参与正极反应,通过交换膜定向移动使电流通过溶液,溶液中离子的定向移动可形成电流,通过5mol电子,则左槽溶液中n(H+)的变化量为10mol-5mol=5mol,
故答案为:5.
本题解析:
本题难度:一般
5、选择题 如图所示,X为铁、Y为石墨电极,a是电解质溶液,实验开始前,在U形管的两边同时滴入几滴酚酞试液,下列叙述错误的是 
?[? ]
A.合上K1、断开K2,若a是稀硫酸,则Y上有 气泡冒出
B.合上K2、断开K1,若a是饱和食盐水,则Y 电极附近溶液慢慢变为红色
C.合上K2、断开K1,若a是硫酸铜溶液,则Y 电极上有红色物质析出
D.合上K2、断开K1,若a是氢氧化铁胶体,则X电极附近红褐色加深
参考答案:C
本题解析:
本题难度:一般