时间:2019-07-03 23:23:25
1、选择题 用NA表示阿伏加德罗常数的值。下列叙述正确的是(?)
A.3.6g碳与3.36LO2一定条件下恰好完全反应,生成CO分子数一定为0.3 NA
B.6.9g钠与足量的CO2和H2O(g)混合气体充分反应,转移的电子数一定为0.3NA
C.25℃时, 0.15mol/L的Na2CO3溶液中,Na+数目为0.3NA
D.标准状况下,2.24L三氯甲烷中含有C-Cl键数目为0.3NA
参考答案:B
本题解析:略
本题难度:一般
2、计算题 有一种氯化钠与氯化钾的混合物,它所含钾与钠的物质的量之比为3∶1。求:
(1)混合物中氯化钾的质量分数。
(2)含1 mol Cl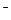 的该混合物的质量。
的该混合物的质量。
参考答案:(1)79.3%? (2)70.5 g
本题解析:(1)NaCl与KCl的物质的量之比等于Na与K的物质的量之比。
则n(NaCl)∶n(KCl)=1∶3。
设NaCl为1 mol,则KCl为3 mol。
则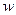 (KCl)=
(KCl)=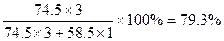 。
。
(2)如果混合物共为1 mol。又因n(NaCl)∶n(KCl)=1∶3
故NaCl为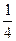 mol,KCl为
mol,KCl为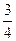 mol,所以混合物质量="58.5" g·mol
mol,所以混合物质量="58.5" g·mol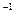 ×
×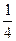 mol+74.5 g·mol
mol+74.5 g·mol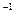 ×
×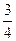 ?mol="70.5" g
?mol="70.5" g
本题难度:简单
3、选择题 阿佛加德罗常数为6.02×1023 mol-1。下列叙述中不正确的是:
A.0.1 mol OH-含有6.02×1023个电子
B.氯化氢气体的摩尔质量等于6.02×1023个氯化氢分子的质量之和
C.1 mol醋酸的质量与6.02×1023个醋酸分子的质量相等
D.28 g氮气所含的原子数目为1.204×1024
参考答案:B
本题解析:略
本题难度:一般
4、选择题 下列与实验相关的叙述正确的是( )
A.稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中
B.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
C.酸碱滴定时,若加入待测液前用待测液润洗锥形瓶,将导致测定结果偏高
D.检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCL2溶液和稀盐酸
参考答案:A、稀释硫酸的操作是将浓硫酸玻璃棒缓慢注入水中,否则会导致酸液飞溅,故A错;
B、若将多余的水取出,会使得浓度偏小,加水超过容量瓶的刻度的唯一办法是重新配制,故B错;
C、用待测液润洗锥形瓶,则消耗的标准液会偏多,导致结果偏高,故C正确;
D、操作中,若溶液中含有Ag+,也会有不溶解于盐酸的白色沉淀产生,则溶液中不一定含有SO42-,故D错;
故选:C.
本题解析:
本题难度:一般
5、填空题 标准状况下,①6.72LCH4 ②3.01×1023HCl分子③0.2mol NH3,这三种气体按质量由大到小排列的顺序是
_____________(填物质的数字代号,下同) ,按氢原子数由少到多排列的顺序是_________________,密度由大到小排列的顺序是________________。
参考答案:②>①>③;②<③<①;②>③>①
本题解析:
本题难度:一般