时间:2019-07-03 23:22:23
1、选择题 下列溶液中有关物质的量浓度关系正确的是
A.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:
c (Na+)>c (CH3COO-)>c(H+)>c(OH-)
B.向NH4HSO4溶液中滴加等物质的量的NaOH形成的溶液中:
c(Na+) =c(SO42-) >c(NH4+) >c(H+) >c(OH-)
C.0.1 mol·L-1Na2CO3溶液与0.1mol·L-1NaHCO3,溶液等体积混合所得溶液:
c(CO32-)+2c(OH-)=c(HCO3- )+c(H2CO3)+2c(H+)
D.相同温度下,pH相等的Na2CO3溶液、C6H5ONa(苯酚钠)溶液、NaOH溶液:c(C6H5ONa)>c(Na2CO3)>c(NaOH)
参考答案:BD
本题解析:pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合酸过量,溶液显酸性,c (CH3COO-)>c (Na+)>c(H+)>c(OH-),A错误。向NH4HSO4溶液中滴加等物质的量的NaOH形成的溶液中铵根水解显酸性, c(Na+) =c(SO42-) >c(NH4+) >c(H+) >c(OH-),B正确。
0.1 mol·L-1Na2CO3溶液与0.1mol·L-1NaHCO3溶液等体积混合所得溶液溶液显碱性,c(CO32-)+2c(OH-)=c(HCO3- )+3c(H2CO3)+2c(H+),C错误。相同温度下,pH相等的Na2CO3溶液、C6H5ONa(苯酚钠)溶液、NaOH溶液,水解程度越大对应的浓度越大,D正确。
本题难度:简单
2、选择题 下列有关电解质溶液中微粒的物质的量浓度关系正确的是(? )
A.pH=3的一元酸和pH=11的一元强碱等体积混合后的溶液中:c(OH-)=c(H+)
B.在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
C.已知叠氮酸(HN3)与醋酸酸性相近,则在NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(OH?)>c(N3?)>c(H+)
D.0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
参考答案:B
本题解析:A、pH=3的一元强酸和pH=11的一元强碱等体积混合后的溶液中:c(OH-)=c(H+),pH=3的一元弱酸和pH=11的一元强碱等体积混合后的溶液中:c(OH-)<c(H+),错误。B、根据溶液中质子守恒得c(OH–) = c(H+) + c(HCO3–) + 2c(H2CO3–),所以c(OH–)-c(H+) = c(HCO3–) + 2c(H2CO3–),正确。C、醋酸根离子可水解,因此醋酸钠溶液显碱性,但水解程度小,c(CH3COO–)>c(OH–),NaN3与CH3COONa相似,其水溶液也显碱性,溶液中的离子浓度大小关系应为:c(Na+)>c(N3?)>c(OH?)>c(H+),错误。D、向0.2?mol/LNaHCO3溶液中加入等体积0.1?mol/LNaOH溶液后,相当于0.05?mol/L的Na2CO3溶液和0.05?mol/L NaHCO3溶液的混合液,由于Na2CO3的水解程度大于NaHCO3的水解程度,因此正确的关系是:c(HCO3–)>c(CO32–)>c(OH–)>c(H+),错误。
本题难度:一般
3、选择题 下列溶液中各微粒的浓度关系正确的是
A.等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=c(Ba2+)
B.0.2mol/L的NaHSO4溶液中:c(Na+)>c(SO42-)> c(H+) > c(OH-)
C.向NH4HCO3溶液中滴加NaOH溶液至中性:c(NH4+)+c(Na+)= c (HCO3-)+c(CO32-)
(HCO3-)+c(CO32-)
D.0.1 mol/L pH=9的NaNO2溶液中:c(Na+)>c(NO2-)>c(OH-) >c(H+)
参考答案:D
本题解析:略
本题难度:简单
4、选择题 向10.00 mL 0.01 mol/L某一元酸HA溶液中逐滴加入0.01 mol/L NaOH 溶液,溶液pH变化曲线如图所示。下列说法不正确的是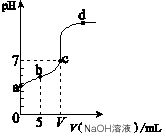
[? ]
A.HA是弱酸
B.b点表示的溶液中:2c(Na+) = c(A-) + c(HA)
C.c点时:V= 10.00 mL
D.b、c、d点表示的溶液中:c(Na+) + c(H+) = c(A-) + c(OH-)
参考答案:C
本题解析:
本题难度:一般
5、选择题 把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和,则混合液中微粒浓度关系正确的是
A.c (CH3COO-)>c (Na+)
B.c (CH3COOH)+c (CH3COO-)="0.02mol/L"
C.c (CH3COOH)>c (CH3COO-)
D.c (OH-)>c (H+)
参考答案:A
本题解析:根据电荷守恒可知c (Na+)+ (H+)=" c" (CH3COO-)+ c (OH-),溶液呈酸性,所以c (OH-)<c (H+),则c (CH3COO-)>c (Na+)。根据物料守恒c (CH3COOH)+c (CH3COO-)="2" c (Na+)=0.01mol/L,所以c (CH3COOH)<c (CH3COO-)。答案选A。
点评:根据三大守恒定律和溶液的酸碱性判断。
本题难度:一般