时间:2019-07-03 23:22:03
1、填空题 (1)氯元素的最高价氧化物为无色液体,0.25 mol 该物质与一定量水混合得到一种稀溶液,并放出Q kJ 的热量。写出该反应的热化学方程式: 。
(2)已知:Fe2O3(s) + 3/2C(s) = 3/2CO2(g) + 2 Fe(s) ΔH =234.1 kJ·mol-1
C(s) + O2(g) = CO2(g) ΔH = —393.5 kJ·mol-1
则2 Fe(s)+ 3/2O2(g) = Fe2O3(s) 的ΔH是 kJ·mol-1。
(3)意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如下图所示。已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ。根据以上信息和数据,写出N4气体转变为N2的热化学方程式: 。
(4)下图是丙烷(C3H8)、二甲醚(CH3OCH3)燃烧过程中能量变化图,其中x为各自反应中对应的系数。根据该图写出二甲醚燃烧的热化学方程式: 。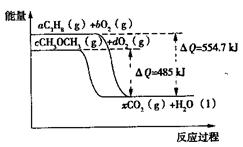
参考答案:(每空3分,共12分)
(1)Cl2O7(l)+H2O(l)==2HClO4(aq);ΔH=-4QkJ/mol
(2)-824.4
(3)N4(g)= N2(g) ΔH=-882kJ/mol
(4)CH3OCH3(g)+3O2(g)→2CO2(g)+3H2O(l) △H=-1455kJ·mol- 1
本题解析:(1)氯元素的最高价氧化物是Cl2O7,0.25molCl2O7与一定量水混合得到HClO4溶液时,放出QkJ的热量,则1molCl2O7与一定量水混合得到HClO4溶液时,放出4QkJ的热量,所以热化学方程式为:
Cl2O7(1)+H2O(1)=2HClO4(aq);△H=-4QkJ?mol-1。
(2)已知:(1)Fe2O2(s)+3/2C(s)=3/2CO2(g)+2Fe(s)△H=234.1kJ?mol-1
(2)C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1
由盖斯定律(2)×(3/2)-(1),得:2Fe(s)+3/2O2(g)=Fe2O3(s)△H=(-393.5kJ?mol-1)×(3/2)-234.1kJ?mol-1
即2Fe(s)+3/2O2(g)=Fe2O3(s)△H=-824.35kJ?mol-1。
(3)1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1molN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为1884KJ,所以反应放热,放出的热量为1884KJ-1002KJ=882KJ,故N4气体转变为N2的热化学方程式是N4(g)= N2(g) ΔH=-882kJ/mol。
(4)由图象可知生成1mol水时,二甲醚燃烧放出485KJ的热量,则生成3mol水,放出的热量为3×485KJ=1455KJ,
所以热化学方程式为CH3OCH3(g)+3O2(g) 2CO2(g)+3H2O(l)△H=-1455kJ?mol-1。
2CO2(g)+3H2O(l)△H=-1455kJ?mol-1。
考点:盖斯定律进的应用 有关反应热的计算 热化学方程式的书写
点评:本题考查盖斯定律的利用、反应热的计算和热化学方程式的书写,难度大,明确已知反应与目标热化学方程式的关系是关键,注意基础知识的掌握与理解。
本题难度:一般
2、选择题 下列每组物质中含有的化学键类型相同的是( )
A.NaCl、HCl、H2O、NaOH
B.Cl2、Na2S、HCl、SO2
C.HBr、CO2、H2O、CS2
D.Na2O2、H2O2、H2O、O3
参考答案:A、NaCl中含有离子键、HCl含有共价键、H2O含有共价键、NaOH含有离子键和共价键,故A不符合;
B、Cl2含有共价键、Na2S含有离子键、HCl含有共价键、SO2含有共价键,故B不符合;
C、HBr、CO2、H2O、CS2分子中含的化学键都是共价键,故C符合;
D、Na2O2含有离子键和共价键、H2O2含有共价键、H2O含有共价键、O3含有共价键,故D不符合;
故选C.
本题解析:
本题难度:简单
3、填空题 下表中的数据是破坏1?mol物质中的化学键所消耗的能量 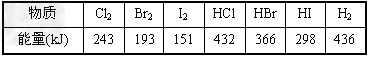
根据上述数据回答下列问题: ?
(1)下列物质本身具有的能量最低的是________。 ?
A.H2?B.Cl2?C.Br2?D.I2 ?
(2)下列氢化物中最稳定的是______。 ?
A.HCl?B.HBr?C.HI ?
(3)?X2+H2=2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应?________。 ?
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是____________。 ?
(5)若无上表中的数据,你能正确回答出问题(4)吗?你的依据是什么?
_________________________________
参考答案:(1)A?
(2)A?
(3)放热反应?
(4)Cl2?
(5)能,元素的非金属性越强,生成的氢化物越稳定,越易生成,放出的热量越多
本题解析:
本题难度:一般
4、选择题 下列物质中,只含有离子键,不含有共价键的是?(?)
A.Na2O2
B.KOH
C.CaCl2
D.CO2
参考答案:C
本题解析:A.Na2O2中Na、O之间为离子键,O、O之间为非极性共价键,故错;
B. KOH中氢氧根之间是共价键,故错;
D、CO2中只有共价键,故错。
故选C。
点评:本题考查化学键,明确化学键的类别及成因是解答本题的关键,难度不大。
本题难度:一般
5、填空题 化学反应可视为旧键断裂和新键形成的过程。现提供H2燃烧反应中有关物质的化学键键能:
H-H Q1kJ/ mol、H-O Q3kJ/ mol、O2分子内氧原子间的键能为Q2kJ/mol。
(1)请根据上述数据,在下图中标注的数字处,填出能量变化的数值或根据箭头的指向填写能量变化是“放出”热量还是“吸收”热量。
①_______②_______③_______④_______⑤_______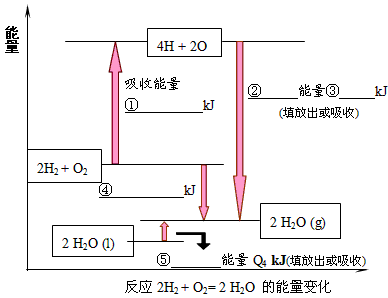
(2)请写出1molH2燃烧生成液态水的热化学反应方程式:____________________________
参考答案:(1)①2Q1+Q2;②放出;③4Q3;④4Q3-(2Q1+Q2);⑤吸收
(2)H2(g)+1/2O2(g)==H2O(l)? ΔH=-1/2[(4Q3+Q4)-(2Q1+Q2)]kJ·mol-1
本题解析:
本题难度:一般