时间:2019-07-03 23:21:21
1、计算题 (10分)(1)12.4 g Na2X含有0.4 mol Na+,Na2X的摩尔质量为_____,其相对分子质量为______,X的相对原子质量为________,该物质的化学式为________。
(2)相同状况下,一定体积的气态氢化物HmX的质量是等体积NH3的2倍。则X的相对原子质量为________。(用含m的代数式表示)
(3)a个X原子的总质量为b g,则X的相对原子质量可表示为________。
(4)20 g A物质和14 g B物质完全反应,生成8.8 g C物质、3.6 g D物质和0.2 mol E物质,则E物质的摩尔质量为________。
(5)483 g Na2SO4·10H2O中所含的Na+的物质的量是 mol,SO42—的物质的量是 mol,所含O原子的数目是 个。
参考答案:(10分,每空1分)(1)62g/mol 62 16 Na2O (2)34-m (3)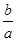 NA
NA
(4)108g/mol (5)3 1.5 21NA
本题解析:考查物质的量的有关计算。
(1)12.4 g Na2X含有0.4 mol Na+,则化合物的物质的量是0.2mol,所以该化合物的摩尔质量是12.4g÷0.2mol=62g/mol;其相对分子质量是62,X的相对分子质量是62-23×2=16,所以X是O,则该化合物是Na2O。
(2)相同状况下,一定体积的气态氢化物HmX的质量是等体积NH3的2倍,则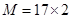 ,解得M=34,所以X原子的相对原子质量是34-m。
,解得M=34,所以X原子的相对原子质量是34-m。
(3)根据M=m/n和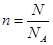 可知,X的相对原子质量可表示为
可知,X的相对原子质量可表示为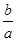 NA。
NA。
(4)根据质量守恒定律可知,E物质的质量是20g+14g-8.8g-3.6g=21.6g,所以E的摩尔质量是21.6g÷0.2mol=108g/mol。
(5)483 g Na2SO4·10H2O的物质的量是483g÷322g/mol=1.5mol,则钠离子的物质的量是3.0mol,SO42-的物质的量是1.5mol。氧原子的物质的量是14×1.5mol=21mol,原子数个数是21NA。
本题难度:一般
2、选择题 下列说法不正确的是
A.6.02×1023就是阿伏加德罗常数
B.0.012 kg C12含有的碳原子数就是阿伏加德罗常数的值
C.含有阿伏加德罗常数个粒子的物质的量是1 mol
D.1 mol NH3所含原子数约是2.408×1024
参考答案:A
本题解析:0.012kg12C中所含的碳原子的个数为阿伏加德罗常数,数值上约为6.02×1023,A错误,B正确;含有阿伏加德罗常数个粒子的物质的量是1 mol,C正确;1 mol NH3所含分子数为6.02×1023,一个氨气分子中含有4个原子,故原子数约为2.408×1024,D正确,答案选A.
考点:阿伏伽德罗常数
本题难度:一般
3、选择题 若20 g密度为ρ g/cm3的Ca(NO3)2溶液里含1 g Ca2+,则NO3—的物质的量浓度是( )
A.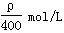
B.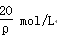
C.2.5 ρmol/L
D.1.25 ρmol/L
参考答案:C
本题解析:20克密度为ρg/cm3的硝酸钙溶液的体积为20g/ρg/cm3=(20/ρ)×10-3L,
1克Ca2+的物质的量为1g/40(g/mol) =0.025mol,
则Ca2+的物质的量浓度为0.025mol/[((20/ρ) ×10-3L) =1.25ρmol/L,
由硝酸钙的化学式Ca(NO3)2,
则NO3-离子的浓度为1.25dmol/L×2=2.5mol/L,
故选C。
点评:本题考查物质的量浓度的计算,明确钙离子的物质的量的计算是解答的关键,钙离子的质量与钙原子的质量可近似相等,忽略电子的质量来分析解答。
本题难度:一般
4、选择题 用NaOH固体配制一定物质的量浓度的溶液时,必须用到的仪器是( )
A.分液漏斗
B.烧瓶
C.容量瓶
D.蒸发皿
参考答案:根据配制一定物质的量浓度的氢氧化钠溶液的步骤可知,配制过程中使用的仪器有:托盘天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管等,所以选项中必须使用的仪器为容量瓶,而分液漏斗、烧瓶和蒸发皿,在配制中不会用到,
故选C.
本题解析:
本题难度:简单
5、选择题 100 mL 0.3mol/L Na2SO4溶液和50mL 0.2mol/LAl2(SO4)3溶液混合后,溶液中SO42-离子的物质的量浓度为( )
A.0.20mol/L
B.0.25mol/L
C.0.40mol/L
D.0.50mol/L
参考答案:C
本题解析:稀溶液混合时可认为总体积为两溶液体积之和。先求出Na2SO4和Al2(SO4)3物质的量,再求SO42-离子浓度。
本题难度:简单