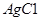时间:2019-07-03 23:17:57
1、推断题 A、B、C、D、E五种短周期元素,已知:
①原子半径递增顺序为:A、D、C、B、E
②短周期(除稀有气体元素外)所有元素中A的原子半径与E的原子半径之比为最小
③B、C、D三种元素电子层相同,三者原子序数之和为21,且D原子次外层电子数为最外层电子数13;
请回答下列问题:
(1)写出E单质在D单质中燃烧产物的电子式:____________________
(2)C2A4·H2O与NH3·H2O相似,水溶液也呈弱碱性,用化学用语表示其水溶液呈弱碱性的原因:__________________;
(3)B、D、E三元素可组成常见化合物X,A、B、D、E可组成常见化合物Y,X、Y均是生活中常见的化学试剂,它们在一定条件下可互相转化。当a?mol?Y转化成a?mol?X时:(溶液中进行)
①若加入a?mol纯净物Z就可实现转化,则加入Z为:________(填一种Z物质名称)
②若加入0.5a?mol纯净物Z就可实现转化,则加入Z为:________(填一种Z物质化学式)
(4)C2A4可用作高能燃料电池的燃料,惰性材料作电极,KOH作电解质溶液构成原电池,写出负极的电极方程式:______________________;用该电池电解含0.25?mol?CuSO4和0.5?mol?NaCl混合溶液,当电池消耗10.4?g?C2A4时,则两电极生成的气体共________mol。
2、选择题 有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常见的无机试剂。E的溶质是一种无色油状液体,B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其他五种溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3沉淀均不溶。
根据上述实验信息,下列说法错误的是( )
A.B可能为NaHCO3溶液
B.F为AgNO3溶液
C.D不可能是镁或铝的盐酸盐
D.A为氨水,E为硫酸
3、推断题 A、B、C、 D、E都是原子序数依次增大的五种短周期元素,已知:
①A和C属同族元素,且A元素的原子半径是短周期元素原子中半径最小的;
②A和B能形成组成为A2B和A2B2的两种化合物;
③D元素原子所形成的离子在同周期元素原子形成的离子中半径是最小的;且D元素原子的最外层电子数是E元素原子最外层电子数的一半。
请回答:
(1)A元素是________;C元素是_________。D元素是_________。E元素是_________。(填元素符号)
(2)化合物A2B2的所含化学键______________电子式是____________;
(3)B和E形成两种常见化合物是_________和_________。
4、简答题 如表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
| ? H | ? | ? | ? | ? | ? | ? | He |
| ? | ? | ? | ? | ? | A | B | ? |
| C | ? | D | ? | E | F | G | ? |
5、选择题 下列有关说法和结论都正确的是
A.已知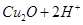 =
=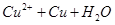 ,氢气还原氧化铜后所得红色固体能完全溶于稀硝酸,说明红色固体是铜
,氢气还原氧化铜后所得红色固体能完全溶于稀硝酸,说明红色固体是铜
B.用蒸馏水、酚酞、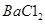 溶液和已知浓度盐酸标准溶液作试剂,可测定NaOH固体(杂质仅为
溶液和已知浓度盐酸标准溶液作试剂,可测定NaOH固体(杂质仅为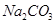 )的纯度
)的纯度
C.将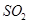 气体通入溴水中,溴水颜色逐渐褪去,说明
气体通入溴水中,溴水颜色逐渐褪去,说明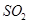 具有漂白性
具有漂白性
D.已知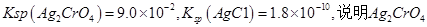 的溶解度小于
的溶解度小于