时间:2019-07-03 23:15:51
1、填空题 (1)Zn
2、填空题 (14分)(1)在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g) 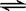 ?4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,则:υ(NO2)为?、5min时,N2O5占混合气体体积分数是?。
?4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,则:υ(NO2)为?、5min时,N2O5占混合气体体积分数是?。
阅读资料,回答(2)、(3)小题
锌铜原电池用画图的方式(如图)表示很不方便,常常采用电池图式表达式,如Zn|ZnSO4(1mol/L)||CuSO4(1mol/L)|Cu?上式中,发生氧化反应的负极写在左边,发生还原反应的正极写在右边。用实垂线“|”表示电极与溶液之间的界面,用双实垂线“||”表示盐桥。
(2)上述资料列举的电池中,锌片上发生的电极反应式是?,
(3)现有一电池,其图式表达式为Cu|CuSO4(1mol/L)||Fe2(SO4)3(0.5mol/L)|C。该电池中,正极的电极反应式是?,负极的电极反应式是?。
(4)写出支链只有一个乙基且式量最小的烷烃的结构简式?
3、选择题 某心脏起搏器的动力来源于Li-SOCl2电池。该电池的总反应可表示为:
4Li+2SOCl2 =" 4LiCl" +S +SO2。下列关于该电池的说法正确的是(?)
A.放电过程中Li+向负极移动
B.该电池的电解质溶液为NaCl水溶液
C.正极电极反应式为: 2SOCl2+4e-= 4Cl— +S +SO2
D.当0.4mol Li完全溶解时,流经电解质溶液的电子个数为2.408×1023
4、选择题 下列烧杯中盛放的都是稀硫酸,在铜电极上能产生气泡的是
[? ]
A.
B.
C.
D.
5、选择题 钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2===2Fe2++4OH-。以下说法正确的是
A.负极发生的反应为:Fe-2e-===Fe2+
B.正极发生的反应为:2H2O+O2+2e-===4OH-
C.原电池是将电能转变为化学能的装置
D.钢柱在水下部分比在空气与水交界处更容易腐蚀