时间:2019-07-03 23:15:31
1、推断题 短周期的四种元素X、Y、Z、W,原子系数依次增大,Z原子最外层电子数是X、Y、W三种原子的最外层电子数之和,Z与X、Y、W三种元素形成原子个数之比为1:1的化合物分别是A.B.C,其中化合物C在空气中容易变质,请回答:
(1)写出Z的原子结构示意图______________________________。
(2)写出化合物YZ2电子式:______________空间构形为:_______________,写出化合物C的电子式:_____________化学键类型有:_____________。
(3)写出化合物C在空气中变质的化学方程式:____________________
参考答案:(1)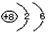 ;
;
(2)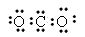 ?;直线型 ;
?;直线型 ;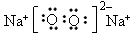 ?;离子键和共价键
?;离子键和共价键
(3)2Na2O2 + 2CO2 === 2Na2CO3 + O2? ;2Na2O2 + 2H2O === 4NaOH + O2↑
本题解析:
本题难度:一般
2、选择题 近年来研制的NF3气体可用作氟化氢—氟化氚高能化学激光器的氟源,也可作为火箭推进剂,NF3可用NH3与氟气制取,化学方程式为:4NH3+3F2===NF3+3NH4F,下列说法中不正确的是
A.NF3的形成过程用电子式可表示为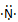 +3:
+3: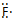 →
→
B.NF3的氧化性大于F2
C.NF3分子空间构型为三角锥形
D.NH4F中既有离子键又有极性共价键
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列物质中微粒的个数比不是1:1的是
A.NaHCO3晶体中的阴离子和阳离子
B.Na2O2固体中的阴离子和阳离子
C.重氢( H)原子中的质子和中子
D.NH3分子中的质子和电子
参考答案:B
本题解析:略
本题难度:一般
4、填空题 铜、碳、氮、硫、氯等是组成物质的重要元素。
(1)S、Cl组成的一种化合物的分子结构与H2O2相似,则此化合物的结构式为________。N、O、S三种元素的电负性由大到小的顺序为____________。
(2)铜离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。某化合物Y与Cu(Ⅰ)(Ⅰ表示化合价为+1)结合形成图甲所示的离子。
①写出Cu(Ⅰ)的电子排布式:____________;
②该离子中含有化学键的类型有________(填序号);
A.极性键
B.离子键
C.非极性键
D.配位键
③该离子中C原子的杂化方式有________。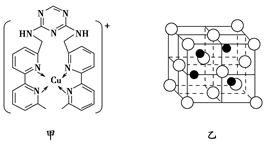
(3)向氯化铜溶液中通入足量的二氧化硫,生成白色沉淀M,M的结构如图乙所示。写出该反应的离子方程式:_____________________________________
___________________________________。
参考答案:(1)Cl—S—S—Cl O>N>S(或O、N、S)
(2)①1s22s22p63s23p63d10(或[Ar]3d10) ②ACD ③sp2、sp3 (3)2Cu2++2Cl-+SO2+2H2O===2CuCl↓+SO42—+4H+
本题解析:(1)S、Cl组成的一种化合物的分子结构与H2O2相似,则采用类比法S元素和O元素是同主族元素,Cl元素和H元素最外层均差1个电子达到稳定结构,所以由H2O2的结构式H—O—O—H,则可知该化合物的结构式为Cl—S—S—Cl,主族元素电负性呈周期性变化规律与非金属性变化规律一致,N、O、S三种元素的电负性由大到小的顺序为O>N>S。(2)①根据Cu元素的原子序数为29,Cu(Ⅰ)的电子排布式为1s22s22p63s23p63d10(或[Ar]3d10)。②根据图所示的离子,其中含有的化学键类型有极性键(N—C)、非极性键(C—C)、配位键(N→Cu),③根据离子的键线式,该离子中C原子存在于苯环和甲基、亚甲基中,所以C原子的杂化方式有sp2、sp3。(3)向氯化铜溶液中通入足量的二氧化硫,生成白色沉淀M,根据M的结构,确定M的化学式为CuCl,则根据得失电子守恒、电荷守恒、原子守恒,该反应的离子方程式为2Cu2++2Cl-+SO2+2H2O===2CuCl↓+SO42—+4H+。
本题难度:一般
5、选择题 实现下列变化时,需克服相同类型作用力的是?
[ ? ]
A、二氧化硅和干冰的熔化
B、液溴和钠的气化
C、食盐和冰的熔化
D、纯碱和烧碱的熔化
参考答案:D
本题解析:
本题难度:简单