时间:2019-07-03 23:15:31
1、填空题 铜、碳、氮、硫、氯等是组成物质的重要元素。
(1)S、Cl组成的一种化合物的分子结构与H2O2相似,则此化合物的结构式为?。
N、O、S三种元素的电负性由大到小的顺序为?。
(2)铜离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。某化合物Y 与Cu(Ⅰ)(Ⅰ表示化合价为+1)结合形成图所示的离子: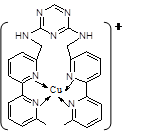
①写出Cu(Ⅰ)的电子排布式?;
②该离子中含有化学键的类型有?(选填序号);
A.极性键
B.离子键
C.非极性键
D.配位键
③该离子中C原子的杂化方式有?。
(3)向氯化铜溶液中通入足量的二氧化硫,生成白色沉淀M,M的结构如图所示。写出该反应的离子方程式?。
参考答案:
(1)Cl—S—S—Cl(2分)? O>N>S(或O、N、S)(2分)
(2)①1s22s22p63s23p63d10(或[Ar]3d10)(2分)
②A、C、D(2分,答对两个给1分,答对三个给2分,错1个倒扣1分)
③sp2 ?sp3(2分)
(3)2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+(2分)
本题解析:
(1)H2O2的分子结构H—O—O—Hl类似于两个O-H键构成的两条异面直线,在这里O,S位于同一主族具有相似性,故结构为Cl—S—S—Cl;N、O元素位于同一周期电负性依次增强,O、S元素位于同主族电负性依次降低,所以电负性由大到小的顺序为O>N>S。
(2)Cu(Ⅰ)指的是铜原子失去了一个电子,所以其电子排布式为1s22s22p63s23p63d10(或[Ar]3d10)。
②根据成绩的特征判断化学键的类型除了没有离子键外其它选项都有。③该离子中C原子存在于苯环和一个甲基中,在苯环中C发生的是sp2 杂化,在甲基中C发生的是 sp3的杂化方式。
(3)由图11可以看出,该沉淀的组成应该由两种元素组成,该晶胞中微粒个数可以计算为:小黑球4个,空心球8*1/8+6*1/2=4,所以这两种元素微粒个数比为1:1。该沉淀由氯化铜溶液中通入足量的二氧化硫反应生成,Cu2+有强的氧化性,SO2具有还原性,产物中应该有Cu+和SO42-生成,那沉淀只能是Cu+和Cl-结合而成的。所以根据氧化还原原理书写方程为2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+。
本题难度:一般
2、简答题 “HCl溶于水后形成H+和Cl-,但HCl不是离子化合物”你怎样理解这一句话。
_____________________________________________________。
参考答案:离子化合物是由阳离子和阴离子形成的化合物。氢元素和氯元素都是非金属元素,这样的原子相互结合时不是发生电子得失,而是形成共用电子对,即HCl是由H原子和Cl 原子通过共价键形成的化合物,属于共价化合物,不是离子化合物。HCl在水溶液里变为H+和Cl-,这是HCl分子受水分子的作用发生电离的结果,不能以这种发生变化以后的结果为条件判定HCl是离子化合物。
本题解析:
本题难度:一般
3、选择题 黑火药是中国四大发明之一,其爆炸的化学反应方程式是:
2KNO3 + 3C + S→ + N2↑ + 3CO2↑?
+ N2↑ + 3CO2↑?
(1)方程式中第二周期元素中非金属性由强到弱的顺序依次为?。
(2)上述元素中,元素原子最外层有2个未成对电子的是?。
(3)在生成物中:A物质的晶体类型为?;构成晶体A的微粒半径大小关系为?(用微粒符号表示);含极性共价键的非极性分子为?。
(4)已知CN—与N2结构相似,写出HCN分子的结构式?。
参考答案:(1)O、 N、 C(2分);(2)C、S、O(2分);(3)离子晶体(1分),S2->K+(1分); CO2(1分)。(4)H-C≡N(1分)
本题解析:根据质量守恒定律,不难确定物质A的化学式:K2S。(1)同周期元素的非金属性,从左往右逐渐增强,方程式中第二周期元素中非金属性由强到弱的顺序依次为O、 N、 C。(2)上述元素中,元素原子最外层有2个未成对电子的是C(2s22p2)、S(3s23p4)、O(2s22p4)。(3)K2S物质的晶体类型为离子晶体;S2-和K+的核外具有相同的电子层结构,核电荷数越大,离子半径越小,微粒半径大小关系为S2->K+;含极性共价键的非极性分子为 CO2。(4)已知CN—与N2结构相似,写出HCN分子的结构式H-C≡N。
本题难度:一般
4、填空题 (15分)氮的化合物在无机化工领域有着重要的地位。请回答下列问题:
(1)基态氮原子的价电子排布图为______。氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子的构型为?形,阳离子中氮的杂化轨道类型为?。
(2)某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域。工业上用氮气与氧化铝和碳在一定条件下反应生成X和CO,X的晶体结构如图所示,工业制备X的化学方程式为____。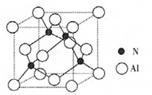
(3)X晶体中包含的化学键类型为______。(填字母标号)
A.离子键
B.共价键
C.配位键
D.金属键
(4)已知氮化硼与X晶体类型相同,且氮化硼的熔点比X高,可能的原因是______
(5)若X的密度为pg/cm3,则晶体中最近的两个N原子的距离为______cm(阿伏加德罗常数用NA表示,不必化简)。
参考答案:(1)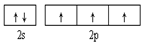 ?直线? sp (2)? Al2O3+N2+3C
?直线? sp (2)? Al2O3+N2+3C 2AlN+3CO?(3)B、C
2AlN+3CO?(3)B、C
(4)氮化硼与氮化铝均为原子晶体,且硼原子半径小于铝原子半径,B—N键键能大于Al—N键键能?(5)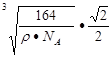
本题解析:(1)7号元素N的核外电子排布式是1s22s22p3,所以基态氮原子的价电子排布图为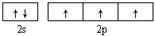 ;氮的最高价氧化物N2O5为无色晶体,它由两种离子构成:NO2+(硝酰阳离子)和NO3-(硝酸根离子),其中阳离子呈直线型,阳离子中氮的杂化轨道类型为sp杂化,阴离子构型为平面正三角形; (2) 工业制备X的化学方程式为Al2O3+N2+3C
;氮的最高价氧化物N2O5为无色晶体,它由两种离子构成:NO2+(硝酰阳离子)和NO3-(硝酸根离子),其中阳离子呈直线型,阳离子中氮的杂化轨道类型为sp杂化,阴离子构型为平面正三角形; (2) 工业制备X的化学方程式为Al2O3+N2+3C 2AlN+3CO;(3)在AlN晶体中包含的化学键类型为共价键、配位键。因此选项为B、C。(4)已知氮化硼与AlN晶体类型相同,且氮化硼的熔点比AlN高,可能的原因是氮化硼与氮化铝均为原子晶体,且硼原子半径小于铝原子半径,使得B—N键的键能大于Al—N键的键能。(5)在每个晶胞中含有的Al原子的个数为:8×1/8+6×1/2=4;N:1×4=4.因此含有4个AlN。设晶胞的变成为L,则
2AlN+3CO;(3)在AlN晶体中包含的化学键类型为共价键、配位键。因此选项为B、C。(4)已知氮化硼与AlN晶体类型相同,且氮化硼的熔点比AlN高,可能的原因是氮化硼与氮化铝均为原子晶体,且硼原子半径小于铝原子半径,使得B—N键的键能大于Al—N键的键能。(5)在每个晶胞中含有的Al原子的个数为:8×1/8+6×1/2=4;N:1×4=4.因此含有4个AlN。设晶胞的变成为L,则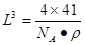 ;
;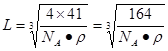 则晶体中最近的两个N原子的距离为
则晶体中最近的两个N原子的距离为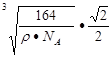 cm。在晶胞中每个Al原子结合4个N原子,每个N原子结合4个Al原子,2个Al原子之间的距离与2个N原子的距离相等,都等于面对角线的一半,所以2个N原子之间的距离等于
cm。在晶胞中每个Al原子结合4个N原子,每个N原子结合4个Al原子,2个Al原子之间的距离与2个N原子的距离相等,都等于面对角线的一半,所以2个N原子之间的距离等于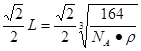 。
。
本题难度:一般
5、填空题 ①Cu、②NaOH、③I2、④MgCl2、⑤Na2O2、⑥Ar,回答下列问题。
(1)不存在化学键的是_________;
(2)存在金属键的是_________;
(3)只存在非极性键的是_________;
(4)只存在离子键的是_______;
(5)既存在离子键又存在极性键的是________;
(6)既存在离子键又存在非极性键的是________。
参考答案:(1)⑥
(2)①
(3)③
(4)④
(5)②
(6)⑤
本题解析 :
本题难度:一般