时间:2019-07-03 23:02:44
1、填空题 回答下列问题。
(1)常温时,FeCl3溶液的pH?7(填“>”、“<”或“=”),实验室配制FeCl3溶液时常将FeCl3固体先溶于较浓的盐酸溶液中,然后再用蒸馏水稀释到所需的浓度,原因是?;将FeCl3溶液蒸干、灼烧,此过程中所涉及到的化学方程式是?。
(2)25℃时,向0.1 mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH减小,主要原因是?。
(3)某溶液中只存在OH-、H+、Na+、CH3COO-四种离子。
①若溶液中只溶解了一种溶质,该溶质的名称是?,该溶液中四种离子的浓度由大到小的顺序为?。
②若溶液中四种离子的大小顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则溶液中溶质的化学式为?。
③若溶液中c(Na+)=c(CH3COO-),则该溶液显?(填“酸性”、“碱性”、“中性”),该溶液由体积相等的稀NaOH和CH3COOH溶液混合而成,则混合前c(NaOH) ??c(CH3COOH)(填“>”、“<”或“=”)。
参考答案:(1)<,(1分)?Fe3+发生水解,加入盐酸后,抑制其水解。(2分)
FeCl3+3H2O Fe(OH)3+3HCl?或FeCl3+3H2O
Fe(OH)3+3HCl?或FeCl3+3H2O Fe(OH)3↓+3HCl ↑( 2分 )
Fe(OH)3↓+3HCl ↑( 2分 )
2Fe(OH)3 Fe2O3+3H2O?(2分)
Fe2O3+3H2O?(2分)
(2)氨水中存在电离平衡NH3·H2O NH4+ + OH-。NH4Cl溶于水,发生电离NH4Cl=NH4++Cl-,产生大量NH4+,使氨水的电离平衡向左移动,溶液中c(OH-)减小。(3分)
NH4+ + OH-。NH4Cl溶于水,发生电离NH4Cl=NH4++Cl-,产生大量NH4+,使氨水的电离平衡向左移动,溶液中c(OH-)减小。(3分)
(3)① 醋酸钠? c(Na+)>c(CH3COO-)>c(OH-)>c(H+)?(每空1分,共2)
②NaOH、CH3COONa?(2分)?③中性,<?(每空1分,共2分))
本题解析:(1)氯化铁是强酸弱碱盐,溶于水铁离子水解溶液显酸性,因此常温时,FeCl3溶液的pH<7;氯化铁是强酸弱碱盐,溶于水铁离子水解溶液显酸性,加入盐酸后,抑制铁离子水解;水解是吸热的,加热促进水解。且生成的氯化氢极易挥发,因此最终得到氢氧化铁固体,进一步灼烧得到氧化铁,反应的反应式有FeCl3+3H2O Fe(OH)3+3HCl或FeCl3+3H2O
Fe(OH)3+3HCl或FeCl3+3H2O Fe(OH)3↓+3HCl↑、2Fe(OH)3
Fe(OH)3↓+3HCl↑、2Fe(OH)3 Fe2O3+3H2O。
Fe2O3+3H2O。
(2)氨水中存在一水合氨的电离平衡NH3·H2O NH4+ + OH-。NH4Cl溶于水,发生电离NH4Cl=NH4++Cl-,产生大量NH4+,增大溶液中c(NH4+)浓度,使一水合氨的电离平衡向左移动,因此溶液中c(OH-)减小。
NH4+ + OH-。NH4Cl溶于水,发生电离NH4Cl=NH4++Cl-,产生大量NH4+,增大溶液中c(NH4+)浓度,使一水合氨的电离平衡向左移动,因此溶液中c(OH-)减小。
(3)①只有醋酸钠能同时电离出Na+、CH3COO-,而任何溶液中都存在水的电离平衡,所以若溶液中只溶解了一种溶质,该溶质的名称是醋酸钠。醋酸钠溶于水电离出的CH3COO-水解溶液显碱性,所以溶液中离子浓度大小关系是c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
②由于醋酸钠的水解程度比较小,所以若溶液中四种离子的大小顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+),这说明溶液是由醋酸钠和氢氧化钠组成的混合液,则溶液中溶质的化学式NaOH、CH3COONa。
③根据电荷守恒可知c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以若溶液中c(Na+)=c(CH3COO-),则溶液中c(OH-)=(H+),所以该溶液显中性。如果醋酸和氢氧化钠恰好中和生成醋酸钠,由于醋酸钠水解溶液显碱性。因此要使溶液显中性,则醋酸一定是过量的。因此若该溶液由体积相等的稀NaOH和CH3COOH溶液混合而成,则混合前c(NaOH)< c(CH3COOH)。
本题难度:一般
2、选择题 室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
A.与AlCl3溶液发生反应的离子方程式为Al3++3OH-===Al(OH)3↓
B.加水稀释后,溶液中c(NH4+)·c(OH-)变大
C.用HNO3溶液完全中和后,溶液不显中性
D.其溶液的pH=13
参考答案:C
本题解析:A.一水合氨是弱电解质,离子方程式中要写化学式,正确的离子方程式为:Al3++3NH3.H2O
本题难度:一般
3、选择题 有甲、乙两醋酸稀溶液,测得甲的pH=2,乙的pH=3。下列推断中正确的是
A.物质的量浓度c(甲)=10c(乙)
B.甲中H+物质的量浓度是乙的0.1倍
C.中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)>10V(甲)
D.甲中的c(OH-)为乙中c(OH-)的10倍
参考答案:C
本题解析:醋酸时弱酸,存在电离平衡,醋酸浓度越小,电离程度越大。所以c(甲)>10c(乙),A不正确,C正确。B不正确,应该是10倍。D不正确,应该是0.1倍,答案选C。
本题难度:一般
4、选择题 下列物质中,最难电离出H+的是
[? ]
A.H2SO4
B.CH3COOH
C.H2O
D.CH3CH2OH
参考答案:D
本题解析:
本题难度:简单
5、填空题 25℃时,有0.01 mol/L的醋酸溶液,醋酸的电离平衡常数表达式_______________________达平衡时,溶液中氢离子浓度是___________________________(25℃时,醋酸的电离平衡常数为1.75×10-5)当向该溶液中加入一定量的盐酸时,电离常数__________________发生变化(填是否)
参考答案:K=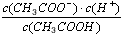 ;4.18×10-4 mol/L;否
;4.18×10-4 mol/L;否
本题解析:
本题难度:一般