时间:2019-07-03 22:59:18
1、填空题 如图所示每条折线表示周期表ⅣA~ⅦA族中某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是____________,b点代表的是__________。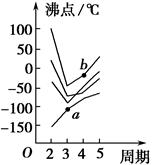
参考答案:SiH4? H2Se
本题解析:第二周期ⅣA~ⅦA族元素分别是C、N、O、F,其氢化物的沸点由高到低的顺序是
H2O>HF>NH3>CH4,因此,由上至下4条折线分别代表ⅥA、ⅦA、ⅤA、ⅣA族元素的氢化物的沸点变化。那么,b点代表的物质是H2Se,a点代表的物质是SiH4。
本题难度:一般
2、选择题 下列说法中,正确的是( )
A.NO2、BF3、NC13分子中没有一个分子中原子的最外层电子都满足8电子稳定结构
B.P4和CH4都是正四面体分子,两种分子中化学键之间的夹角相等且均为109°28′
C.(NH4)2SO4晶体中只有离子键
D.由原子间通过共价键而形成的晶体具有高熔、沸点及硬度
参考答案:D
本题解析:
本题难度:一般
3、填空题 有H、C、O、Cl、Na五种元素。
(1)在由两种元素组成的化合物里,其中离子化合物有(写2种)______________________,共价化合物有(写2种)______________________。
(2)在由三种元素组成的化合物里,其中离子化合物有(写2种)______________________,共价化合物有(写2种)______________________。
参考答案:(1)Na2O、NaCl、Na2O2;CO2、CO、CH4、H2O(任写2种) (2)Na2CO3、NaClO;H2CO3、HClO
本题解析:含有离子键的化合物是离子化合物,全部由共价键形成的化合物是共价化合物,所以由H、C、O、Cl、Na五种元素中:
(1)由两种元素组成的化合物里,其中离子化合物有Na2O、NaCl、Na2O2等,共价化合物有CO2、CO、CH4、H2O等。
(2)由三种元素组成的化合物里,其中离子化合物有Na2CO3、NaClO等,共价化合物有H2CO3、HClO、HClO2、HClO3、HClO4等。
点评:该题是基础性试题的考查,难度不大。明确离子化合物和共价化合物的含义以及与化学键关系是答题的关键,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:简单
4、选择题 .下列说法正确的是:
A.在化合物SiC中,Si显正价、C显负价是因为C的电负性大于Si的电负性
B.由于H与F的电负性差值为1.9大于1.7,所以HF是离子化合物
C.基态C原子有两个未成对电子,所以最多只能形成2个共价键
D.所有的原子轨道都具有一定的伸展方向,因此所有的共价键都具有方向性
参考答案:A
本题解析:B.HF是共价化合物;电负性判断晶体类型是很笼统的,可能出现很多反例,不过常常可有对应的解释。如HF中,如果H电离成H+,将是一个裸露的质子,吸电子能极强,会导致F-变形,回到共价状态。
C.C原子可以发生杂化,sp3杂化,最多可以形成4个共价键;
D.由于s轨道是球形的,所以当两个s轨道电子形成共价键时,没有方向性。
本题难度:简单
5、计算题 物质结构理论有助于人们理解物质变化的本质,进行分子设计和研究反应规律。请回答下列问题:
(1)第三周期基态原子有2个未成对电子且电负性最大的元素是_____;
(2)金属晶体受到外力作用时易发生形变,而离子晶体容易破裂。试从结构的角度分析其中的主要原因____________;
(3)已知在水中存在平衡2H2O=H3O++OH-。下列分子中,中心原子采取的杂化方式与H3O+中氧原子的杂化方式相同的是_____
a.CH2=CH2中的碳原子? b.NH2-中的氮原子
c.ClO3-中的氯原子? d.NO2-中的氮原子
(4)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中Mg元素的质量分数为________。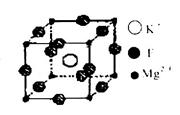
参考答案:(1)S(或硫磺)(1分) (2)金属晶体是由金属阳离子和“自由电子”通过金属键形成的层状紧密堆积结构(1分),当金属受外力作用时,金属晶体中各原子层会发生相对滑动,产生形变,自由电子使得各层之间始终保持着金属键的作用(1分)。离子晶体中由于阴阳离子间存在着静电作用,使阴阳离子不能发生自由移动,因而受到外力作用时离子键被破坏而使晶体破裂(1分)
(3)bc(2分) (4)20%(2分)
本题解析:(1)第三周期基态原子中含有两个未成对电子的元素有Si、S两种元素,同一周期中,元素的电负性随着原子序数的增大而增大,所以Si的电负性小于S元素。
(2)金属晶体的构成微粒是金属阳离子和自由电子,存在的作用力是金属键,金属晶体是由金属阳离子和自由电子通过金属键形成的层状紧密堆积结构。当金属受外力作用时,金属晶体中各原子层会发生相对滑动,产生形变,自由电子使得各层之间始终保持着金属键的作用;离子晶体中存在的微粒是阴阳离子,存在的作用力是离子键,离子晶体中由于阴阳离子间存在着静电作用,使阴阳离子不能发生自由移动,因而受到外力作用时离子键被破坏而使晶体破裂。
(3)H3O+中中心氧原子含有3个σ键和一个孤电子对,所以其价层电子对数是4,则氧原子采取sp3杂化。a.CH2═CH2中的每个碳原子含有3个σ键且不含孤电子对,所以采取sp2杂化,故错误;b.NH2-中的氮原子含有2个σ键和(5+1-2×1)÷2=2个孤电子对,所以氮原子采取sp3杂化,故b正确;c.ClO3-中的氯原子含有3个σ键和(7+1-3×2)÷2=1个孤电子对,所以其价层电子对数是4,则氯原子采取sp3杂化,故c正确;d.NO2-中的氮原子含有2个σ键和(5+1-2×2)÷2=1个孤电子对,所以其价层电子对数是3,所以氮原子采取sp2杂化,故d错误,因此答案选bc。
(4)根据晶胞结构并依据均摊法可知,该晶胞中含有镁原子个数=8×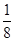 =1,钾原子个数=1,氟原子个数=12×
=1,钾原子个数=1,氟原子个数=12×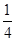 =3,所以其化学式为KMgF3,因此该化合物中镁元素的质量分数=
=3,所以其化学式为KMgF3,因此该化合物中镁元素的质量分数=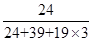 ×100%=20%。
×100%=20%。
本题难度:一般