时间:2019-06-28 22:56:20
1、选择题 对于室温下pH=3的醋酸,下列叙述正确的是
A.加水稀释后,醋酸的电离程度增大,溶液的导电性增强
B.c(H+)=c(CH3COO-)+c(OH-)
C.加入少量醋酸钠固体后,恢复至室温,溶液中c(CH3COO-)?c(H+)/c(CH3COOH)不变
D.与等体积pH=11的NaOH溶液混合后,pH=7
参考答案:BC
本题解析:醋酸溶液存在如下平衡:CH3COOH H++CH3COOˉ,稀释能促进醋酸的电离,但是c(H+)、c(CH3COOˉ)均减小,稀释后溶液的导电性减弱,故A错误;醋酸溶液存在的离子有氢离子、醋酸根离子和氢氧根离子,根据电荷守恒原理可得:c(H+)=c(CH3COO-)+c(OH-),故B正确;加入醋酸钠固体,能增大c(CH3COOˉ),使醋酸的电离平衡左移,但是溶液中c(CH3COO-)?c(H+)/c(CH3COOH)不变,因为c(CH3COO-)?c(H+)/c(CH3COOH)的比值就是醋酸的电离平衡常数,只与温度有关,温度不变,平衡常数不变,故C正确;pH=3,醋酸溶液中c(H+)=0.001mol/L,由于醋酸部分电离出氢离子,则c(CH3COOH)>0.001mol/L,pH=11,NaOH溶液中c(OHˉ)=Kw/ c(H+)=0.001mol/L,由于NaOH完全电离,则c(NaOH)=0.001mol/L,因此c(CH3COOH)>c(NaOH),等体积混合时醋酸过量,混合后溶液呈酸性,pH<7,故D错误。
H++CH3COOˉ,稀释能促进醋酸的电离,但是c(H+)、c(CH3COOˉ)均减小,稀释后溶液的导电性减弱,故A错误;醋酸溶液存在的离子有氢离子、醋酸根离子和氢氧根离子,根据电荷守恒原理可得:c(H+)=c(CH3COO-)+c(OH-),故B正确;加入醋酸钠固体,能增大c(CH3COOˉ),使醋酸的电离平衡左移,但是溶液中c(CH3COO-)?c(H+)/c(CH3COOH)不变,因为c(CH3COO-)?c(H+)/c(CH3COOH)的比值就是醋酸的电离平衡常数,只与温度有关,温度不变,平衡常数不变,故C正确;pH=3,醋酸溶液中c(H+)=0.001mol/L,由于醋酸部分电离出氢离子,则c(CH3COOH)>0.001mol/L,pH=11,NaOH溶液中c(OHˉ)=Kw/ c(H+)=0.001mol/L,由于NaOH完全电离,则c(NaOH)=0.001mol/L,因此c(CH3COOH)>c(NaOH),等体积混合时醋酸过量,混合后溶液呈酸性,pH<7,故D错误。
本题难度:一般
2、实验题 为了测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A.冷却至室温后,在250mL容量瓶中定容配成250mL稀硫酸。
B.用某仪器量取25.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C.将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D.将物质的量浓度为M mol/L的标准NaOH溶液装入碱式滴定管,调节液面记下开始读数为V1mL。
E.小心滴入NaOH标准溶液,边滴边摇动锥形瓶,滴定至恰好反应为止,记下读数为V2mL。
F.把锥形瓶移到碱式滴定管下,在锥形瓶下垫一张白纸。
G.用某仪器准确量取浓硫酸样品10.00 mL,在烧杯中用蒸馏水溶解。
请完成下列填空:
⑴正确操作步骤的顺序(用编号字母填写)??。?
⑵用来量取10.00mL浓硫酸的仪器是?,用NaOH溶液润洗碱式滴定管的目的是??。
⑶滴定中可选用的指示剂是?,滴定中,目光应注视___? __ 。
⑷某学生实验时用稀硫酸润洗了锥形瓶测定的浓度会偏_?。(填“偏高”、“偏低”或“无影响”)
参考答案:(1)G A C D B F E?(2分)
(2)移液管(或酸式滴定管)?保证标准液浓度不被稀释?(各1分)
(3)酚酞(或甲基橙)?锥形瓶中溶液颜色变化和滴定管液体滴下速度(各1分)
(4)偏高?(1分)
本题解析:(1)根据中和滴定原理和实验要求可知,正确的操作顺序是G A C D B F E。
(2)浓硫酸显酸性,应该用酸式滴定管或移液管来量取,但不能用量筒,因为量筒只能读数到0.1ml。如果不用氢氧化钠溶液润洗碱式滴定管,则会降低氢氧化钠溶液的浓度,从而引起误差。所以用NaOH溶液润洗碱式滴定管的目的是保证标准液浓度不被稀释。
(3)强酸和强碱之间的滴定,指示剂可以是酚酞,也可以是甲基橙。滴定过程中,目光应注视锥形瓶中溶液颜色变化和滴定管液体滴下速度。
(4)实验时用稀硫酸润洗了锥形瓶,则导致硫酸的物质的量增加,消耗的氢氧化钠增多,所以测定结果偏高。
点评:该题是基础性试题的考查,试题注重对教材基础知识的考查和学生实验能力的培养。该题基础性强,难易适中,重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般
3、选择题 下面均是正丁烷与氧气反应的热化学方程式(25℃.101 kPa):
①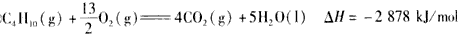
②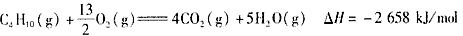
③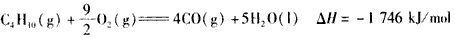
④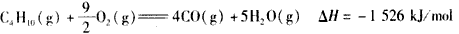
由此判断,正丁烷的燃烧热是
[? ]?
A.-2 878 kJ/mol
B.-2 658 kJ/mol
C.-1 746 kJ/mol
D.-1 526 kJ/mol
参考答案:A
本题解析:
本题难度:一般
4、选择题 对于常温下pH为1的硝酸溶液,下列叙述正确的是(?)
A.该溶液1 mL稀释至100 mL后,pH等于3
B.向该溶液中加入pH为13的氢氧化钡溶液恰好完全中和
C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12
D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍
参考答案:A
本题解析:硝酸为强电解质,完全电离,稀释100倍,pH增大2,A项正确。不知道HNO3和Ba(OH)2溶液的体积,B项错。硝酸电离出的c(H+)为0.1 mol·L-1,由水电离出的c(H+)为10-13 mol·L-1,二者之比应为1012,C项错。pH为3的硝酸中水电离出的c(H+)为10-11 mol·L-1,故D项应为10-2,D项错。
本题难度:一般
5、简答题 已知下列热化学方程式:
①H2(g)+
| 1 2 |
| 1 2 |
| 1 2 |
参考答案:(1)△H<0的反应属于放热反应;△H>0的反应属于吸热反应.根据给出的热化学方程式可知:①②④三个反应的)△H<0属于放热反应;反应③△H>0属于吸热反应;
故答案为:①②④;
(2)根据燃烧热的定义知:H2燃烧时生成液态水更稳定,所以H2(g)+12O2(g)═H2O(l);△H=-285.8kJ?mol-1 就是氢气的燃烧热化学方程式,其燃烧热△H=-285.8kJ?mol-1;
故答案为:-285.8kJ?mol-1;
(3)由热化学方程式①可知
H2(g)+12O2(g)═H2O(l) Q
2g 285.8KJ
10g 1429KJ
故答案为:1429KJ;
(4)根据燃烧热的定义,碳燃烧生成的两种氧化物中,二氧化碳更稳定,故其燃烧的热化学方程式为:C(s)+O2(g)═CO2(g);△H=-393.5kJ?mol-1;
故答案为:C(s)+O2(g)═CO2(g);△H=-393.5kJ?mol-1.
本题解析:
本题难度:一般