时间:2019-06-28 22:48:28
1、选择题 下列说法正确的是
①CH3COONa、BaSO4都是强电解质;?②中和滴定过程中,应注视锥形瓶内溶液颜色的变化,以准确把握滴定终点;?③测定溶液的PH值时,用玻璃棒蘸取少量溶液点在湿润的pH试纸上再与标准比色卡对照;?④ 0.1 mol·L-1 NaOH溶液与0.1 mol·L-1 Ba(OH)2溶液的PH相同;?⑤日用铝制品表面覆盖着氧化膜,对内部金属起保护作用。
A.①②④
B.①②⑤
C.②③⑤
D.③④⑤
参考答案:B
本题解析:①正确,强电解质是指在水溶液中或熔融状态下全部电离的电解质。CH3COONa溶于水且全部电离,BaSO4虽难溶于水,但溶于水的那部分是全部电离的,属于强电解质;
②正确,中和滴定过程中操作方法:左手控制活塞,右手振荡锥形瓶,两只眼睛注视锥形瓶内溶液颜色的变化;③错,测定溶液的PH值时,不能将pH试纸润湿,会稀释溶液导致PH值可能会发生变化;④错,0.1 mol·L-1 NaOH溶液与0.1 mol·L-1 Ba(OH)2溶液中氢氧根离子的浓度不同,氢氧化钡溶液中氢氧根离子的浓度是氢氧化钠溶液的2倍,PH不相同;⑤正确,铝露置于空气中表面会形成一致密而薄的氧化物保护膜。
本题难度:一般
2、选择题 已知一些银盐的颜色及溶解度数值如下:
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| 溶解度/g | 1.5×10-4 | 7.1×10-7 | 2.1×10-7 | 1.3×10-16 | 4.3×10-2 |
参考答案:D
本题解析:使用铬酸钾做指示剂,只有当浓度比较大是才产生红色沉淀,说明氯离子沉淀完全。
本题难度:一般
3、选择题 在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH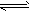 CH3COO-+H+,下列叙述正确的是
CH3COO-+H+,下列叙述正确的是
[? ]
A.加入水时,平衡向逆反应方向移动
B.加入少量CH3COONa固体,平衡向正反应方向移动
C.加入少量0.1mol·L-1HCl溶液,平衡向逆反应方向移动,溶液中c(H+)增大
D.加入少量NaOH固体,平衡向正反应方向移动
参考答案:CD
本题解析:
本题难度:一般
4、选择题 下列物质:①盐酸 ②食盐水 ③熔化的氯化钠 ④液态氯化氢 ⑤铜 ⑥氨水 ⑦SO3 ⑧醋酸,其中可以导电并且属于强电解质的是( )
A.只有③
B.①②③⑥⑧
C.④⑤
D.全部都是
参考答案:A
本题解析:①有自由移动的电子或自由移动离子的物质能导电;②根据电解质的定义:必须是化合物,在水溶液里或熔融状态下有自由移动的离子,且离子是物质本身电离的,不能是与其它物质反应后的物质电离的;③能全部电离的电解质是强电解质;只有部分电离的电解质是弱电解质。①盐酸-HCl的水溶液,混合物,能导电 ②食盐水-NaCl的水溶液,能导电 ③熔化的氯化钠
本题难度:一般
5、选择题 下列事实能说明醋酸是弱酸的是
① 醋酸钠溶液中CH3COO-与CH3COOH共存
② 0.1 mol/L的醋酸钠溶液的pH值约为9
③ 等体积、等浓度的硫酸和醋酸溶液与氢氧化钠反应,硫酸溶液消耗的氢氧化钠多
④ 0.1mol/L的醋酸的pH值约为4.8
⑤ pH值等于4、体积相等的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸液消耗碱液多
A.①②④⑤
B.②④
C.②③④
D.②③
参考答案:A
本题解析:醋酸钠溶液中CH3COO-与CH3COOH共存,有弱才水解,有CH3COOH生成,①正确;0.1mol/L的CH3COONa溶液的pH约为9,有弱才水解,水解显碱性,则醋酸为弱酸,②正确;等体积等物质的量浓度的H2SO4溶液比等体积等物质的量浓度的CH3COOH溶液消耗的NaOH溶液多,是因硫酸为二元酸,不能说明醋酸为弱酸,故③错误;0.1mol/L的CH3COOH溶液pH约为4.8,说明醋酸电离不完全,存在电离平衡,则说明醋酸为弱酸,④正确;相同体积的pH均等于4的盐酸和CH3COOH溶液,被同一物质的量浓度的NaOH溶液中和,CH3COOH溶液消耗的NaOH溶液多,说明醋酸的浓度大于10-4mol/L,即醋酸为弱酸,⑤正确;答案选A
考点:弱电解质在水中的电离平衡
本题难度:一般