时间:2019-06-28 22:47:27
1、填空题 (14分)(1)在一定温度下,向1L体积固定的密闭容器中加入1mol A(g),发生反应2A(g) B(g)+C(g),B的物质的量随时间的变化如图所示。 0—2min内的平均反应速率v(A)= ?. 相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时?是原来的2倍。
B(g)+C(g),B的物质的量随时间的变化如图所示。 0—2min内的平均反应速率v(A)= ?. 相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时?是原来的2倍。
a.平衡常数? b. A的平衡浓度?
c.平衡时混合气体的密度? d.平衡时B的体积分数
(2)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡??移动(填“向左”“向右”或“不”);若加入少量下列试剂中的??,产生H2的速率将增大。
a.NaNO3? b.CuSO4 ?
c.Na2SO4?d.NaHSO3?
e.? CH3COOH?
(3)用惰性电极电解Cu(NO3)2溶液一段时间后,加入a mol 的Cu(OH)2可使溶液恢复原状,则电解过程中转移的电子数目为_____________
(4)已知:2Zn(s)+O2(g)=2ZnO(s)?△H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s)?△H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)?△H=_____________
(5)已知25℃时,Ksp[Cu(OH)2]=2×10-20,要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为 。
参考答案:(共14分)(1)0.1mol/(L·min) ; b c (2)向右?; b
(3)4a NA?(4)-259.7 kJ·mol-1?(5)6
本题解析:(1)在0—2min内B增加了0.1mol,则根据反应式A减少了0.2mol,所以起反应速率是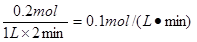 。由于反应前后体积不变,所以若开始加入A(g)的物质的量是原来的2倍,则平衡时A的平衡浓度和平衡时混合气体的密度都是原来的2倍,ac都是不变的,答案选bc。
。由于反应前后体积不变,所以若开始加入A(g)的物质的量是原来的2倍,则平衡时A的平衡浓度和平衡时混合气体的密度都是原来的2倍,ac都是不变的,答案选bc。
(2)锌和稀硫酸反应生成氢气,则溶液中氢离子的浓度降低,所以水的电离平衡向正反应方向移动,即向右移动。b可以构成铜锌原电池,加快反应速率。a中不再产生氢气,b不影响,d会消耗氢离子,近似反应速率。醋酸是弱酸,不能增大氢离子的浓度,答案选b。
(3)入a mol 的Cu(OH)2可使溶液恢复原状,说明在反应中阴极还产生氢气,但阳极始终是OH-放电产生氧气。a mol Cu(OH)2中含有2amol氧原子,所以反应中转移的电子是2amol×2=4amol。
(4)考查盖斯定律的应用,(①-②)÷2即得到Zn(s)+ HgO(s)=ZnO(s)+ Hg(l),所以反应热是(-701.0kJ·mol-1+181.6kJ·mol-1)÷2=-259.7 kJ·mol-1.
(5)根据溶度积常数的表达式可知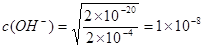 ,则氢离子浓度是
,则氢离子浓度是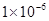 ,所以pH=6.
,所以pH=6.
本题难度:一般
2、实验题 (15分)乙醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H)。再水解生成乙醇。写出相应的反应的化学方程式?
(2)已知:
甲醇脱水反应①2CH3OH(g)=CH3OCH3(g)+H2O(g)?△H1=-23.9KJ·mol-1
甲醇制烯烃反应②2CH3OH(g)=C2H4 (g)+2H2O(g)? △H2=-29.1KJ·mol-1
乙醇异构化反应③CH3CH2OH(g)=CH3OCH3(g))? △H3=+50.7KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的?△H=? KJ·mol-1
与间接水合法相比,气相直接水合法的优点是:?。
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中n(H2O)︰n(C2H4)=1︰1)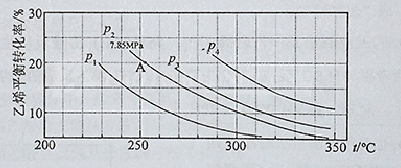
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数K=?(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②图中压强P1、P2、P3、P4的大小顺序为:?,理由是:?
③气相直接水合法党采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9MPa,n(H2O)︰n(C2H4)=0.6︰1。乙烯的转化率为5℅。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有:??、?。
参考答案:(1)C2H4+H2SO4= C2H5OSO3H; C2H5OSO3H+H2O=C2H5OH+ H2SO4;
(2) -45.5?污染小,腐蚀性小等;(3)①K=0.07(MPa)-1; ②P1< P2< P3< P4;反应分子数减少,相同温度下,压强升高,乙烯转化率提高;? ③将产物乙醇液化转移去,增加n(H2O):n(C2H4)的比。
本题解析:(1)根据题意可得乙烯与浓硫酸反应生成硫酸氢乙酯C2H5OSO3H的方程式:C2H4+H2SO4= C2H5OSO3H; C2H5OSO3H+H2O=C2H5OH+ H2SO4;(2)①-②-③,整理可得C2H4 (g)+H2O(g)=C2H5OH(g),△H=(-23.9+29.1-50.7)KJ/mol=-45.5 KJ/mol;与间接水合法相比,气相直接水合法的优点是污染小,腐蚀性小等;(3)①乙烯水合制乙醇反应在图中A点的平衡常数K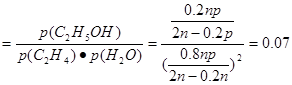 (MPa)-1; ②在相同的温度下由于乙烯是平衡转化率是P1< P2< P3< P4;由方程式C2H4 (g)+H2O(g)=C2H5OH(g)可知该反应的正反应是气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是:P1< P2< P3< P4; ③若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有改变物质的浓度,如从平衡体系中将产物乙醇分离出去,或增大水蒸气的浓度,改变二者的物质的量的比等等。
(MPa)-1; ②在相同的温度下由于乙烯是平衡转化率是P1< P2< P3< P4;由方程式C2H4 (g)+H2O(g)=C2H5OH(g)可知该反应的正反应是气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是:P1< P2< P3< P4; ③若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有改变物质的浓度,如从平衡体系中将产物乙醇分离出去,或增大水蒸气的浓度,改变二者的物质的量的比等等。
本题难度:一般
3、选择题 在体积可变的密闭容器中,反应mA(g)+nB(s) pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中正确的是
pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中正确的是
A.(m+n)必定小于p
B.(m+n)必定大于p
C.m必定小于p
D.n必定大于p
参考答案:C
本题解析:略
本题难度:一般
4、计算题 (8分)将等物质的量的A、B混合于1 L的密闭容器中,发生如下反应
3A(g)+B(g)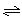 ?xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
?xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
(1)此时A的浓度c(A)=________mol/L,反应开始前容器中的A、B的物质的量:n(A)=n(B)=________mol。
(2)B的平均反应速率v(B)=________mol/(L·min)。?
(3)x的值为________。
参考答案:(1)0.75,1.5? (2)0.05? (3) 2?(每空2分)
本题解析:考查可逆反应的有关计算。
(1)C的平均反应速率是0.1mol/(L·min),则C的浓度是0.5mol/L,所以根据变化量之比是相应的化学计量数之比可知x=2。又因为反应速率之比是相应的化学计量数之比,所以B的反应速率是0.1mol/(L·min)÷2=0.05mol/(L·min)。
(2)? 3A(g)+B(g) 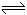 2C(g)+2D(g)
2C(g)+2D(g)
起始量(mol)? n? n? 0? 0
转化量(mol)? 0.5? 0.25? 0.5? 0.5
平衡量(mol)? n-0.75? n-0.25? 0.5? 0.5
所以有(n-0.75)︰(n-0.25)= 3:5
解得n=1.5mol,所以A的浓度是0.75mol÷1L=0.75mol/L
本题难度:一般
5、选择题 关于平衡常数,下列说法不正确的是
A.平衡常数随温度的改变而改变
B.使用催化剂不能改变平衡常数
C.平衡常数不随反应物或生成物浓度的改变而改变
D.增大压强促使平衡向正反应方向进行,则平衡常数增大
参考答案:D
本题解析:平衡常数只与温度有关,温度改变,平衡常数一定改变,与反应物、生成物的浓度无关,所以A、C正确;催化剂只改变反应速率,不会改变平衡,所以平衡常数不变,B错误;平衡正向移动,平衡常数增大,D正确;故选D。
本题难度:简单