时间:2019-06-28 22:41:15
1、选择题 已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
[? ]
参考答案:B
本题解析:
本题难度:一般
2、简答题 科学家要研究跟碳元素及其化合物相关的很多课题.
(1)焦炭可用于制取水煤气.测得12g碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量,该反应的热化学方程式是______.
(2)工业上可用焦炭冶炼金属,若0.5mol碳完全与赤铁矿反应,得到0.6mol铁,同时生成2种常见气体,则该反应的化学方程式是______.
(3)碳跟水蒸气制水煤气的反应是一个可逆反应,下列情况下能判断该反应一定达到平衡状态的是______(选填编号).
a.v正(H2O)=v正(H2) b.容器中温度不再发生改变
c.消耗n mol H2同时消耗n mol CO d.容器中气体的总物质的量不随时间改变
(4)温度T1时,在一体积为2L的密闭容积中,加入2.0mol CO和2.0mol的H2,反应中c(H2O)的变化情况如图所示,T1时反应[C(s)+H2O(g)?CO(g)+H2(g)]的平衡常数的数值为______.在第5分钟时将体系的温发升高到T2,若在第8分钟时达到新的平衡,请在如图中画出第5分钟到9分钟后c(H2O)浓度变化趋势的曲线(只要求定性表示).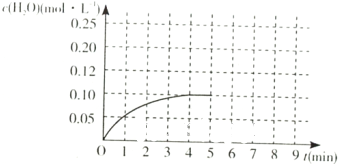
参考答案:(1)12g碳的物质的量为1mol,与水蒸气完全反应生成CO、H2,吸收131.6kJ热量,该反应的热化学方程式C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6kJ?mol-1,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6kJ?mol-1;
(2)0.5mol碳完全与赤铁矿反应,得到0.6mol铁,同时生成2种常见气体,气体为CO2、CO,令生成CO2、CO的物质的量分别为xmol、ymol,根据C原子守恒有x+y=0.5,根据电子转移守恒有4x+2y=0.6×3,联立解得x=0.4、y=0.1,CO2、CO的系数为4:1,故该反应的方程式为5C+3Fe2O3高温.4CO2↑+CO↑+6Fe,
故答案为:5C+3Fe2O3高温.4CO2↑+CO↑+6Fe;
(3)C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6kJ?mol-1,
a.v正(H2O)=v正(H2),依据反应可知自始至终v正(H2O)=v正(H2),不能说明反应到达平衡,故a错误;
b.反应是吸热反应,容器中温度不变,说明反应达到平衡,故b正确;
c.根据反应可知,消耗n mol H2同时消耗n mol CO,反应逆向进行不能说明反应到达平衡,故C错误;
d.反应前后气体的物质的量发生变化,随反应进行气体的物质的量增加,容器中气体的总物质的量不随时间改变,说明反应到达平衡,故d正确;
故选:bd;
(4)温度T1时,在一体积为2L的密闭容积中,加入2.0mol CO和2.0mol的H2,反应中c(H2O)的变化情况如图所示,
C(s)+H2O(g)?CO(g)+H2(g)
起始量(mol/L) 0 0 1 1
变化量(mol/L) 0.1 0.1 0.1
平衡量(mol/L) 0.1 0.9 0.9
T1时反应C(s)+H2O(g)?CO(g)+H2(g)的平衡常数=0.9×0.90.1=8.1;
在第5分钟时将体系的温发升高到T2,若在第8分钟时达到新的平衡,在反应是吸热反应升温平衡正向进行,水的浓度减小,如图中画出第5分钟到9分钟后c(H2O)浓度变化趋势的曲线为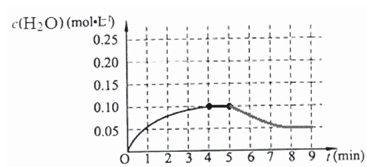 ,
,
故答案为:8.1; .
.
本题解析:
本题难度:一般
3、选择题 已知下列热化学方程式:
①CH3COOH(1)+202(g)=2CO2(g)+2H2O(1) △H1=" —870.3" kJ·mol—1
②C(s)+O2(g)=CO2(g) △H2=" —393.5" kJ·mol—1
③H2(g)+1/2O2(g)=H2O(1) △H3=" —285.8" kJ·mol—1
则反应④2C(s)+2H2(g)+O2(g)=CH3COOH(1)的焓变为( )
A.+488.3 kJ·mol—1
B.—224.15 kJ·mol—1
C.—488.3 kJ·mol—1
D.+244.15 kJ·mol—1
参考答案:C
本题解析:考查盖斯定律的应用。将②×3+③×2-①即得到2C(s)+2H2(g)+O2(g)=CH3COOH(1),所以反应热为2△H2+2△H3-△H1=—393.5 kJ/mol×2—285.8 kJ/mol×2+—870.3 Kj/mol=—488.3 kJ/mol,所以正确的答案是C。
本题难度:一般
4、选择题 已知:① C(s)+O2(g)=CO2(g) △H1; ② CO2(g)+C(s)=2CO(g) △H2;
③ 2CO(g)+O2(g)=2CO2(g) △H3; ④ 4Fe(s)+3O2(g)=2Fe2O3(s) △H4;
⑤3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列判断正确的是
A.上述反应中△H1~ H5均大于0
B.△H1=△H2- △H3
C.3△H3=△H4 + 2 △H5
D.△H5=3△H1+△H4
参考答案:C
本题解析:A.由于① C(s)+O2(g)=CO2(g)是放热反应,△H1<0,所以选项A错误;B. ②+③,整理可得:C(s)+O2(g)=CO2(g),故△H1=△H2+ △H3,错误;C.④+2×⑤,整理可得:6CO(g)+3O2(g)=6CO2(g) .即3△H3=△H4 + 2 △H5,正确;D. ①×3+④,整理可得:3C(s)+6O2(g)+ 4Fe(s)=3CO2(g)+ 2Fe2O3(s)。与⑤不等。故△H5与3△H1+△H4不同,错误。
考点:考查盖斯定律的应用的知识。
本题难度:一般
5、选择题 已知C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH1=-a kJ/mol
C2H5OH(g)=C2H5OH(l) ΔH2=-b kJ/mol
H2O(g)=H2O(l) ΔH3=-c kJ/mol
若使92 g酒精液体完全燃烧,最后恢复到室温,则放出的热量(单位kJ)为( )
A.4a+4b+4c
B.2a-2b+6c
C.2a-2b+2c
D.2a-6b+2c
参考答案:B
本题解析:解答本题时注意以下两点:
(1)室温时乙醇和水均为液态。
(2)运用盖斯定律对热化学方程式进行叠加。
本题难度:一般