时间:2019-06-28 22:39:12
1、简答题 某化学兴趣小组为探索工业废料的再利用,在实验室中用含有铝、铁、铜的合金制取氯化铝溶液、绿矾晶体和胆矾晶体.其实验方案如下:
(1)所加试剂①、②分别是______、______.
(2)从滤液E中得到绿矾晶体的实验操作是______;从滤渣F制取胆矾的第一步操作最好采用______.
(3)上述实验方案中,有一步设计明显不合理,请你予以指出,并说明理由______、______.
你认为正确的设计方案是______.
参考答案:(1)金属铝和氢氧化钠反应,加入NaOH溶液后金属铝溶解生成偏铝酸钠溶液,金属铁和金属铜不与氢氧化钠反应,
铁和硫酸反应生成硫酸亚铁而金属铜不反应,可以实现三种金属的分离,故答案为:NaOH溶液;稀硫酸;
(2)滤液E中含硫酸亚铁溶液,要得到硫酸亚铁晶体,要经过蒸发浓缩、冷却结晶,考虑到亚铁离子易被氧化,应隔绝空气防氧化.
滤渣F中含铜,由铜制取硫酸铜,从环保角度考虑,采用铜与氧气反应不会产生污染物,然后用硫酸溶解氧化铜得硫酸铜.
故答案为:在隔绝空气的条件下,蒸发浓缩、冷却结晶;将滤渣F在空气中灼烧;
?(3)偏铝酸钠和过量的盐酸反应生成氯化铝和氯化钠的混合物,而向偏铝酸钠中通入足量的二氧化碳,
会得到纯净的氢氧化铝沉淀,再用盐酸溶解,所得溶液的成分只有氯化铝,故答案为:由滤液A制得氯化铝溶液不合理,
所得氯化铝溶液中含有大量NaCl杂质?向滤液A中通入足量的CO2得Al(OH)3沉淀,过滤,向Al(OH)3沉淀中加入盐酸至沉淀溶解.
本题解析:
本题难度:一般
2、选择题 下列实验的设计不可行的是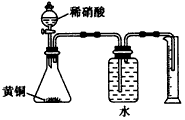
[? ]
A.向生石灰上滴加浓氨水可以制取少量的NH3
B.用水就能一次性鉴别溴苯、苯、乙酸三种物质
C.用如图所示的装置测定黄铜(Cu、Zn合金)中Zn的含量
D.为了除去Na2SO4溶液中的Na2SO3,应加入H2O2
参考答案:C
本题解析:
本题难度:一般
3、实验题 铁是人体必需的微量元素,如果人长期缺铁,会引起缺铁性贫血,导致某些疾病,如口角炎与舌炎、萎缩性胃炎与胃酸缺乏、皮肤干燥、角化和萎缩、毛发易折与脱落、指甲不光整、扁平甲、反甲和灰甲等症状。常见的治疗方法是服用补铁药物,市场上一种常见的药物其商品名称为:速力菲,药品正式名称为:琥珀酸亚铁薄膜片,本品为黄棕色薄膜衣片,除去薄膜衣后显暗黄色,药片中Fe2+的含量为34.0%~36.0%。该药片在水和乙醇中溶解度不大。现某学校化学实验小组,为了检测“速力菲”药片中亚铁元素 的存在,设计了如下几组实验:
理论设计方案: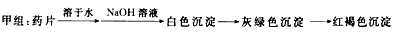 ?
?
甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果,请你分析,可能的原因是什么?
(1)甲组实验失败的原因__________________________________;
乙组同学认真思考了甲组实验失败的原因,模拟药片服用后在人体中溶解的变化过程,重新设计并完成下列实验: ?
?
(2)试剂1为______________________,
试剂2为______________________,加入试剂2后,溶液为什么显示淡红色?___________________________, 加入双氧水溶液后,为什么红色加深?_________________________________________,产生的气体可能是_________________________,写出产生气体的化学方程式:_____________________________。
参考答案:(1)该药片在水中溶解度不大,少量溶解后的溶液中几乎不存在Fe2+,所以得不到预期的实验现象
(2)盐酸;KSCN溶液;在溶解过程中有少量Fe2+已经氧化成Fe3+,与SCN-结合成浓度较小的红色[Fe(SCN)]3+络离子;加入的H2O2能将Fe2+氧化为Fe3+,导致溶液中Fe3+浓度增大,[Fe(SCN)]2+络离子浓度也随之增大,所以红色加深;氧气;2H2O2 2H2O+O2↑
2H2O+O2↑
本题解析:
本题难度:一般
4、实验题 实验室需要0.1 mol/L NaOH溶液450 mL根据计算用托盘天平称取NaOH的质量为?g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度?0.1 mol/L
(填“大于”、“等于”或“小于”,下同)。若NaOH在溶解后未冷却到室温,便注入容量瓶内并将洗涤液一并转移到容量瓶,并定容,则所得溶液浓度?0.1 mol/L。
参考答案: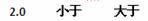
本题解析:略
本题难度:一般
5、简答题 已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性.现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解.
甲同学的解释是.Mg(OH)2(固)?Mg2++2OH-…①
NH4++H2O?NH3?H2O+H+…②H++OH-=H2O…③
由于NH4+水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是.Mg(OH)2(固)?Mg2++2OH-…①NH4++OH-?NH3?H2O…②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH-结合,生成了弱的电解质NH3?H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解.
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是______(填写编号).
A.NH4NO3B.CH3COONH4C.Na2CO3D.NH3?H2O
(2)请你说明丙同学作出该选择的理由______
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理______(填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊溶解的离子方程式______.
参考答案:(1)硝酸铵和氯化铵相似,只有铵根离子的水解,而碳酸钠和氨水溶液都呈碱性,注意B符合,
故答案为:B;
(2)醋酸铵溶液呈中性,可证明是否由于铵根离子水解呈酸性的原因导致氢氧化镁溶解,
故答案为:醋酸铵溶液显中性;
(3)将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解,可说明乙同学的解释正确,
则NH4Cl饱和溶液使Mg(OH)2悬浊溶解的离子方程式为2NH4++Mg(OH)2=2NH3?H2O+Mg2+,
故答案为:氯化铵溶液乙;2NH4++Mg(OH)2=2NH3?H2O+Mg2+.
本题解析:
本题难度:一般