时间:2019-06-28 22:36:49
1、简答题 化合物KxFe(C2O4)y-zH2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成.
I.制备:
(1)结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是______.
(2)操作Ⅲ的名称是______.
Ⅱ.组成测定:
称取0.491g实验所得晶体(假设是纯净物)置于锥形瓶中,加足量蒸馏水和稀H2SO4.将C2O42-完全转化为H2C2O4,用0.10mol-L-1KMnO4溶液进行滴定,消耗KMnO4溶液12.00mL时恰好反应;再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液2.00mL.相关反应如下:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(3)配制250mL?0.10mol-L-1KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有______和______.两个滴定中到达终点时溶液颜色为______色,且30秒内不变色.
(4)通过计算,求此光敏材料的化学式______.
参考答案:I.(1)由题目信息可知,化合物KxFe(C2O4)y?zH2O(Fe为+3价)是一种光敏感材料,推知黑暗是为了防止晶体见光分解.
故答案为:黑暗可以防止晶体分解.
(2)操作Ⅲ前一步是冷却结晶,结晶后自然要将晶体与母液分离,所以需要过滤,晶体表面有吸附的杂质,洗涤后再进行重结晶提纯.
故答案为:过滤、洗涤.
Ⅱ.(3)配制250mL?0.10mol?L-1KMnO4溶液,由已有的仪器可知,还需要250mL容量瓶;
由已有的仪器可知,滴定实验还需要滴定管,KMnO4溶液有强氧化性,可以发生橡皮管,需用酸式滴定管盛放;
该实验是氧化还原滴定,终点时KMnO4溶液恰好过量一滴,溶液会显紫红色,30秒内不变色.
故答案为:250mL容量瓶、酸式滴定管;?紫红.
(4)由MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O可知,n(Fe3+)=5n(MnO4-)=5×0.002L×0.10mol?L-1=0.001mol,由2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O可知,n(C2O42-)=52n(MnO4-)=52×0.012L×0.10mol?L-1=0.003mol,所以0.001mol:0.003mol=1:y,解得y=3,根据化合价代数和为0可知,x+3+3×(-2)=0,解得x=3,由铁元素守恒可知,化合物KxFe(C2O4)y?zH2O等于Fe3+的物质的量为0.001mol,所以计算该化合物摩尔质量为0.491g0.001mol=491g/mol,所以
3×39+56+3×88+18z=491,解得z=3,故该化合物的化学式为K3Fe(C2O4)3?3H2O.
故答案为:K3Fe(C2O4)3?3H2O.
本题解析:
本题难度:一般
2、选择题 如图曲线a和b是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是( )
A.盐酸的物质的量浓度为1mol?L
B.P点时反应恰好完全,溶液早中性
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用作本实验的指示剂
参考答案:B
本题解析:
本题难度:简单
3、简答题 化学探究小组用H2C2O4(草酸)溶液测定KMnO4溶液的浓度.请回答下列问题:
I、取20.00mL0.250mol/L?H2C2O4标准溶液置于锥形瓶中,加入适量稀硫酸酸化,用KMnO4溶液进行滴定.滴定反应方程式为(未配平):
KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O
记录数据如下:
| 滴定次数 | 标准溶液体积/mL | 待测溶液体积/mL 滴定前刻度 滴定后刻度 1 20.00 1.50 23.70 2 20.00 1.02 21.03 3 20.00 2.00 21.99 | |
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s 1 25 5.0 2.0 40 2 25 5.0(另外加少量MnSO4粉末) 2.0 4 3 60 5.0 2.0 25 |
参考答案:I、(1)KMnO4溶液具有强氧化性,可以腐蚀橡皮管,应装在酸式滴定管中;
故答案为:酸式;
(2)草酸反应完毕,加入最后一滴KMnO4溶液,溶液变为红色,红色30s内不褪去,说明滴定到终点;
故答案为:加入最后一滴KMnO4溶液,溶液变为红色,且30s内红色不褪去;
(3)第1组KMnO4溶液的体积与第2、3组相差比较大,应舍掉,应按第2、3组计算消耗KMnO4溶液的体积,故消耗KMnO4溶液的体积为(21.03-1.02)mL+(21.99-2.00)mL2=20mL,令KMnO4溶液的浓度为cmol/L,由2KMnO4~5H2C2O4可知:20mL×cmol/L=25×20mL×0.250mol/L,解得c=0.100;
故答案为:0.100;
(4)由关系式2KMnO4~5H2C2O4可知V(KMnO4)?c(KMnO4)=25V(H2C2O4)?c(H2C2O4),即c(KMnO4)=25V(H2C2O4)?c(H2C2O4)V(KMnO4)
A.滴定管用水洗净后直接注入KMnO4溶液,高锰酸钾溶液被稀释,使用的高锰酸钾溶液的体积偏大,测定的高锰酸钾的浓度偏低,故A符合;
B.锥形瓶用蒸馏水洗净后没有干燥,对草酸的物质的量没有影响,故对测定的高锰酸钾的浓度无影响,故B不符合;
C.滴定管内在滴定前有气泡,滴定后气泡消失,导致酸性高锰酸钾溶液的体积读数偏大,测定的高锰酸钾的浓度偏低,故C符合;
D.读取KMnO4溶液体积时,滴定前平视,滴定结束后俯视读数,导致酸性高锰酸钾溶液的体积读数偏小,测定的高锰酸钾的浓度偏高,故D不符合;
故选AC;
Ⅱ、(5)对比第1、2组实验,第2组实验加入MnSO4,褪色时间短,反应速率快,说明Mn2+对反应具有催化作用,对比第1、3组实验,第3组实验温度升高,褪色时间短,反应速率快,说明温度升高,反应速率加快,由此可知由慢到快的原因是:反应生成的Mn2+对反应起催化剂作用,反应放热使温度升高,加快反应速率快;
故答案为:反应生成的Mn2+对反应起催化剂作用,反应放热使温度升高,加快反应速率快;
本题解析:
本题难度:一般
4、选择题 下列有关化学实验的操作或说法中,正确的是
[? ]
A.为检验酸性溶液中的Cl-和SO42-,要先加硝酸银溶液,滤去沉淀后再加硝酸钡溶液
B.用有少量蒸馏水的锥形瓶装待测液进行中和滴定实验,会导致测定结果偏低
C.配制溶液的操作中,转移溶液后,玻璃棒、烧杯未洗涤使得所配溶液浓度偏高
D.除去FeCl2溶液中少量的FeCl3,采取的措施是加入足量铁屑充分反应后过滤
参考答案:D
本题解析:
本题难度:一般
5、填空题 现有常温条件下的甲、乙、丙三种溶液。甲为0.1mol·L-1的NaOH溶液,乙为 0.1mol·L-1的HCl溶液,丙为0.1mol·L-1的CH3COOH溶液,试回答下列问题
(1)乙溶液中,由水电离出的c(H+)=____________ mol·L-1;
(2)丙溶液中存在的电离平衡为________________________________(用电离平衡方程式表示);
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为____________;
(4)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题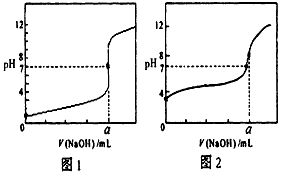
①甲溶液滴定丙溶液的曲线是_____________(填“图1”或“图2”);
②a=____________mL。
参考答案:(1)10-13?
(2)CH3COOH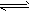 CH3COO-+H+, H2O
CH3COO-+H+, H2O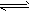 OH-+H+
OH-+H+
(3)丙>甲=乙
(4)①图2;②20.00
本题解析:
本题难度:困难