时间:2019-06-28 22:29:39
1、选择题 已知常温时红磷比白磷稳定,在下列反应中
P4(白磷,s)+5O2(g) =2P2O5(s) △H= -akJ/mol
4P(红磷,s)+5O2(g) =2P2O5(s) △H= -bkJ/mol
若a、b均大于零,则a和b的关系为
[? ]
A.a>b
B.a=b
C.a<b
D.无法确定
参考答案:A
本题解析:
本题难度:一般
2、选择题 在CO跟O2的反应中,破坏1molCO中的化学键消耗的能量为A,破坏1molO=O键消耗的能量为B,形成1molC=O键释放的能量为C。则下列关系正确的是
A.2A+B>2C B.2A+B>4C C.2A + B < 2C D.2A + B < 4C
参考答案:D
本题解析:反应热就是断键形成的能量和形成化学键所放出的能量的差值,CO燃烧是放热反应,则根据方程式2CO+O2=2CO2和物质的结构式可知,一定有2A+B<4C,答案选D。
考点:考查反应热的计算
点评:该题是基础性试题的考查,主要是考查学生对反应热与化学键键能关系的熟悉了解程度,有利于培养学生的逻辑思维能力和抽象思维能力。明确化学键键能与反应热的关系是答题的关键。
本题难度:一般
3、填空题 (8分)(1)已知2 mol氢气燃烧生成液态水时放出572 kJ热量,反应方程式是2H2(g)+O2(g)===2H2O(l) 请回答下列问题:
①该反应的生成物能量总和________(填“大于”、“小于”或“等于”)反应物能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量________(填“>”、“<”或“=”)572 kJ。
(2)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g) 
参考答案:
本题解析:
本题难度:困难
4、填空题 CO2的固定和利用在降低温室气体排放中具有重要作用,从CO2加氢合成甲醇不仅可以有效缓解减排压力,还是其综合利用的一条新途径。CO2和H2在催化剂作用下能发生反应CO2+3H2 CH3OH+H2O,测得甲醇的理论产率与反应温度、压强的关系如图所示。请回答下列问题:
CH3OH+H2O,测得甲醇的理论产率与反应温度、压强的关系如图所示。请回答下列问题:
(1)提高甲醇产率的措施是 。
(2)分析图中数据可知,在220 ℃、5MPa时,CO2的转化率为 ,再将温度降低至
140℃,压强减小至2MPa,化学反应速率将 (填“增大、减小 或 不变“ 下同),CO2的转化率将 。
(3)200℃时,将0.100molCO2和0.275molH2充入1L密闭容器中,在催化剂作用下反应达到平衡。若CO2的转化率为25%,则此温度下该反应的平衡常数K= 。(要求写出算式和计算结果)
(4)已知已知:CO的燃烧热△H=-283.0KJ/mol、2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ/mol、
CO(g)+2H2(g)=CH3OH(g) △H=-90.1KJ/mol,写出CO2与H2合成甲醇的热化学方程式 。
参考答案:(1)降温、加压(2分) (2)25%(2分) 减小(2分) 增大(2分)
(3)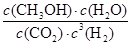 =
=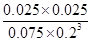 =1.04 (3分)
=1.04 (3分)
(4)CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ?H=-48.9 kJ/mol(3分)
本题解析:(1)根据图像可知,随着温度的升高,甲醇的产率降低,这说明正方应是放热反应。再温度相同时,增大压强,甲醇的产率增大,所以提高甲醇产率的措施是降温、加压。
(2)分析图中数据可知,在220 ℃、5MPa时,甲醇的产率是25%。根据碳原子守恒,1molCO2生成1mol甲醇,因此甲醇的产率就是CO2的转化率,所以CO2的转化率为25%。降温并同时降低压强,反应速率减小。由于正方应是放热的体积减小的可逆反应,因此降温和降低压强平衡均向正反应方向移动,所以CO2的转化率增大。
(3) CO2(g)+3H2(g)===CH3OH(g)+H2O(g)
起始浓度(mol/L)0.100 0.275 0 0
转化浓度(mol/L)0.0250 0.0750 0.0250 0.0250
平衡浓度(mol/L)0.0750 0.200 0.0250 0.0250
所以该温度下反应的平衡常数K=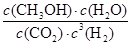 =
=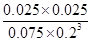 =1.04
=1.04
(4)CO的燃烧热△H=-283.0KJ/mol,则有热化学方程式①2CO(g)+O2(g)=2CO2(g) △H=-566.0KJ/mol。又因为反应②2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ/mol、③CO(g)+2H2(g)=CH3OH(g) △H=-90.1KJ/mol,所以根据盖斯定律可知,(③×2-①+②)÷2,及得到反应CO2(g)+3H2(g)===CH3OH(g)+H2O(g),所以该反应的反应热?H=(-90.1KJ/mol×2+566.0KJ/mol-483.6KJ/mol)÷2=-48.9 kJ/mol。
考点:考查考查外界条件对反应速率和平衡状态的影响;反应速率和平衡常数的计算以及盖斯定律的应用
本题难度:困难
5、选择题 下列热化学方程式书写正确的是( )
A.2SO2+O2 2SO3 ΔH=-196.6 kJ·mol-1
2SO3 ΔH=-196.6 kJ·mol-1
B.C(s)+O2(g)===CO2(g) ΔH=+393.5 kJ·mol-1
C.H2(g)+Cl2(g)===HCl(g) ΔH=-92.5 kJ·mol-1
D.H+(aq)+OH-(aq)===H2O(l) ΔH=+57.3 kJ
参考答案:C
本题解析:A不正确,没有标明状态。B不正确,碳燃烧是放热反应,△H小于0。D中反应也是中和反应,不正确,所以正确的答案选C。
本题难度:简单