时间:2019-06-28 22:25:51
1、选择题 下列物质既含有离子键又含有共价键的是
[? ]
A.SO2 ?
B.H2O
C.NaCl?
D.NaOH
参考答案:D
本题解析:
本题难度:简单
2、填空题 在氢气与氯气反应生成氯化氢气体的反应中,若断裂1mol?H-H键要吸收436KJ的能量,断裂1mol?Cl-Cl键要吸收243KJ的能量,断裂1molH-Cl键要吸收432KJ的能量,在氯气中充分燃烧1mol?H2?的能量变化是______.
参考答案:在反应H2+Cl2?点燃?.?2HCl中,断裂1molH-H键,1molCl-Cl键共吸收的能量为:436kJ+243KJ=679kJ,生成2molHCl,共形成2molH-Cl键,放出的能量为:2×432KJ=864kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:864kJ-679kJ=185kJ,故答案为:放出185KJ的能量.
本题解析:
本题难度:一般
3、选择题 下列说法或表示正确的是?
A.NH3、H2O、PCl3都是极性分子
B. CO2的分子示意图:
C.H2O2的电子式: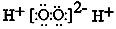
D.CS2、C6H6、C2H2都是直线型分子
参考答案:A
本题解析:CO2分子的比例模型应为 ,H2O2为共价化合物,电子式不能有[ ]电荷,C6H6为平面型分子。所以,B、C、D选项错。A正确。
,H2O2为共价化合物,电子式不能有[ ]电荷,C6H6为平面型分子。所以,B、C、D选项错。A正确。
本题难度:一般
4、填空题 A、B、C是三种短周期元素,其中A元素原子M层上电子数比L层少2个电子;B元素原子比A元素原子的电子层少,又知B元素最高正价与负化合价的绝对值相等;C?元素的阳离子核外电子排布与Ne原子核外电子排布相同;且又知这三种元素可组成BA2型共价化合物和C2A型离子化合物.由上述条件回答下列问题:
(1)A、B、C三元素的名称分别是:A______,B______,C______.
(2)化合物C2A的电子式是______.
(3)化合物BA2的电子式是:______,结构式是:______.
参考答案:A、B、C是三种短周期元素,其中A元素原子M层上电子数比L层少2个电子,则M层电子数为8-2=6,故A为硫元素;B元素原子比A元素原子的电子层少,又知B元素最高正价与负化合价的绝对值相等,B处于第二周期,最外层电子数为4,则B为碳元素;C?元素的阳离子核外电子排布与Ne原子核外电子排布相同,C处于第三周期,形成C2A型离子化合物,C为+1价离子,故C为Na元素,
(1)由上述分析可知,A为硫,B为碳,C为钠,故答案为:硫;碳;钠;
(2)Na2S由钠离子与硫离子构成,电子式为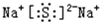
,故答案为: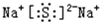
;
(3)CS2分子中碳原子与硫原子之间形成2对共用电子对,电子式为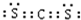
,结构式为S=C=S,故答案为: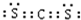
;S=C=S.
本题解析:
本题难度:一般
5、选择题 图为元素周期表短周期的一部分.关于A~G七种元素的叙述正确的是( )
A.E、F、G形成的单质中都含有共价键
B.形成的简单阴离子半径:E>F>C>D
C.B、C、D三种元素的氢化物的稳定性依次减弱
D.A、B、E的氢化物都能跟HNO3发生化合反应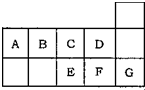
参考答案:A、E、F、G形成的单质分别为:S、Cl2、Ar,Ar为单原子分子,不存在共价键,故A错误;
B、C、D、E、F的阴离子分别为:O2-、F-、S2-、Cl-,其中O2-、F-核外有2个电子层,S2-、Cl-有3个电子层,则S2-、Cl-半径大于O2-、F-,根据核外电子排布相同的离子,核电核数越大半径越小判断离子半径,则有O2->F-,S2->Cl-,故S2->Cl->O2->F-,故B正确;
C、元素的非金属性越强,对应氢化物的稳定性就越大,已知非金属性B<C<D,B、C、D三种元素的氢化物的稳定性依次增强,故C错误;
D、A、B、E的氢化物分别是CH4、NH3、H2S,只有NH3能与硝酸化合,故D错误.
故选B.
本题解析:
本题难度:一般