时间:2019-06-28 22:16:34
1、实验题 (15分)MnO2在酸性溶液中具有强氧化性,可被还原为Mn2+,它还对H2O2的分解具有良好的催化效果。某兴趣小组通过实验研究MnO2的性质。
(1)该小组设计了如下3个方案以验证MnO2的氧化性,可行的是 。
A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298K,设计如下对比试验。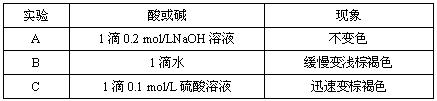
该小组从上述对比实验中,可以得出的结论是 。
写出在酸性条件下,MnO2氧化I-的离子方程式 ?。
(3)欲探究MnO2的催化效果,需要用30%的H2O2溶液(密度近似为1g/cm3)配制浓度3%的H2O2溶液(密度近似为1g/cm3)100mL。其配制方法是:用量筒量取 ?mL30%H2O2溶液放入 (填仪器名称)中,再加入一定量的水,搅拌均匀。
(4)在实验时,某同学把1滴KI溶液误滴入到过量的5 mL 3%的H2O2溶液中,发现产生了大量气泡。该小组查阅到KI与H2O2可发生如下反应:2KI+H2O2 =KOH +I2,认为有可能是反应产物I2起了催化H2O2分解的作用。请设计一个简单实验证明该假设是否正确。 。
(5)实验室用二氧化锰和浓盐酸制取干燥的氯气,下列仪器中不需要用到的是?(填序号)。
a.长颈漏斗? b.圆底烧瓶? c.温度计? d.酒精灯? e.洗气瓶? f.烧杯
参考答案:
(1)A?(2分)
(2)酸性越强,MnO2氧化性越强?(2分)?
MnO2 + 2I-+ 4H+ =Mn2++I2 + 2H2O?(3分)
(3)10.0?烧杯?(各2分)
(4)取5mL3%的H2O2溶液于试管中,滴入1滴碘水,观察是否有大量气泡产生,若有说明假设正确;反之假设不正确 ?(2分)
?(2分)
(5)a、c?(2分)
本题解析:略
本题难度:简单
2、实验题 MgSO4·7H2O医药上用作泻剂。工业上用氯碱工业中的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。主要工艺如下:
(1)用硫酸调整溶液pH到1~2,硫酸的作用是?。 (2)加次氯酸钠溶液至pH=5~6并加热煮沸约5~10分钟,滤渣中主要含MnO2和另两种沉淀,另两种沉淀是????(写化学式)。其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为:??。
(2)加次氯酸钠溶液至pH=5~6并加热煮沸约5~10分钟,滤渣中主要含MnO2和另两种沉淀,另两种沉淀是????(写化学式)。其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为:??。
(3)若除杂后过滤,发现滤液发黄,需采取的措施是?。
(4)过滤后晶体常用丙酮代替蒸馏水洗涤的目的是?。
(5)晶体中结晶水含量的测定:准确称取0.20g MgSO4·7H2O样品,放入已干燥至恒重的瓷坩埚,置于马弗炉中,在200℃脱水1小时。为准确确定脱水后的质量,还需要经过的操作有:冷却(干燥器中)至室温→?。
(6)硫酸根离子质量分数的测定:准确称取自制的样品0.50g,用200mL水溶液,加入2mol·L-1HCl溶液5mL,将溶液加热至沸,在不断搅拌下逐滴加入5~6mL0.5mol·L-1BaCl2溶液,充分沉淀后,得沉淀0.466g,则样品中w(SO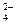 )=?。
)=?。
参考答案:
本题解析:略
本题难度:一般
3、实验题 现在许多食品都采用密封包装,但包装袋中的空气、水蒸气仍会使食品氧化、受潮变质,因此一些食品包装袋中需放入一些脱氧剂,以使食品保质期更长一些。甲、乙、丙三同学为了探究“脱氧剂”的成分,从某食品厂的月饼包装袋中取出“脱氧剂”一袋,打开封口,将其倒在滤纸上,仔细观察,脱氧剂为灰黑色粉末,还有少量的红色粉末。
[提出问题]:该脱氧剂中的黑色、红色粉末各是什么?
[作出猜想]:
甲同学认为:灰黑色粉末可能是氧化铜、红色粉末可能是铜。
乙同学认为:灰黑色粉末可能是铁粉,也可能还有少量的活性炭粉;红色物质是氧化铁。
丙同学认为:灰黑色物质可能是氧化铜、活性炭粉,红色粉末可能是铜。
(1)你认为______同学的猜想正确,其理由是_____________。
(2)设计一个实验方案来验证该同学的猜想是正确的。请填写以下实验报告
参考答案:(1)乙;作为“脱氧剂”它的主要成分应该是种能与空气中的O2和水蒸气反应的比较活泼的物质
(2)①步骤:用一块磁铁接近(或接触)该脱氧剂;结论:灰黑色物质大部分是铁粉;
②现象:红色物质溶解,得到棕黄色溶液,加NaOH后,生成红褐色沉淀;
结论:脱氧剂中的红色物质是氧化铁
本题解析:
本题难度:一般
4、实验题 (15分)某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)试用实验室提供的下列试剂,设计两个原理不同的简单实验(只要写出实验的方案即可),证明镁元素的金属性比铝元素强。
试剂:镁条、铝条、氯化铝溶液、氯化镁溶液、稀盐酸、氢氧化钠溶液
方案一:_____________________________________________________________;
方案二:_____________________________________________________________。
Ⅱ.利用下图装置可验证同周期元素非金属性的变化规律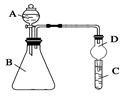
(1)仪器A的名称为________,干燥管D的作用为________________。
(2)若要证明非金属性:Cl>S,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加___________,观察到C中溶液___________________________的现象,即可证明。反应的离子方程式为________________________________________________________。
从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气。
(3)若要证明非金属性:N>C,则在A中加稀硝酸,B中加碳酸钙,C中加澄清石灰水;观察到C中溶液变浑浊的现象,即可证明。该实验原理为______________________________。但有的同学在实验中一切操作正确的情况下没观察到上述现像,试分析可能的原因是___________________________。
参考答案:Ⅰ(1)方案一:用形状大小相同的铝条和镁条分别一等体积等浓度的稀盐酸反应,观察其反应速率快慢?(2分)
方案二:分别向等体积等浓度的氯化铝溶液、氯化镁溶液中加入氢氧化钠溶液至过量,观察其沉淀及其溶解情况(2分)
Ⅱ(1)分液漏斗;防倒吸(每空1分)
(2)硫化钠溶液(1分)有黄色沉淀生成(1分) S2-+Cl2=2Cl-+S↓(2分) 氢氧化钠溶液(1分)
(3)利用非金属元素最高价氧化物对应水化物酸性强弱来比较元素非金属性强弱 (2分)?硝酸有挥发性,随二氧化碳一起逸出(2分)
本题解析:Ⅰ(1)方案一:判断金属性强弱可以依据金属与酸反应的剧烈程度,因此可以设计金属与相同浓度的盐酸生成气体的剧烈程度判断镁和铝金属性强弱;
方案二:根据氢氧化镁、氢氧化铝是否溶于强碱设计,过量碱液可使生成的Al(OH)3溶解,而Mg(OH)2则不溶,具体方法:分别向等体积等浓度的氯化铝溶液、氯化镁溶液中加入氢氧化钠溶液至过量,观察其沉淀及其溶解情况;
Ⅱ(1)根据仪器结构特点可知A为分液漏斗;球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中;
(2)若要证明非金属性:Cl>S,可以利用单质之间的置换反应。B中产生氯气,则在C中加入硫化钠溶液,;氯气与硫化钠分子置换反应生成氯化钠和单质硫,所以观察到C中溶液有黄色沉淀生成的现象,即可证明,反应的离子方程式为S2-+Cl2=2Cl-+S↓;氯气是一种有毒气体,必须进行尾气吸收,氯气能够与氢氧化钠溶液反应,可以使用氢氧化钠溶液吸收多余的氯气;
(5)要证明非金属性是N>C,则可以利用最高价氧化物水化物的酸性强弱来比较,依据较强的酸可以制备较弱的酸可知,如果在A中加稀硝酸,B中加碳酸钙,则B中产生CO2,CO2能使澄清石灰水变浑浊,因此C中加澄清石灰水;观察到C中溶液变浑浊的现象,即可证明。由于硝酸有挥发性,随二氧化碳一起逸出进入澄清的石灰水,因此没观察到上述现像。
本题难度:一般
5、选择题 下列实验操作安全合理的是
A.加热KMnO4制O2时,为防止试管破裂和胶管腐蚀,试管口略向下倾斜,管口放一团棉花
B.进行SO2性质实验时要在通风橱内进行,多余的SO2一律排到室外
C.白磷有毒,用剩的白磷要用CS2处理后倒入垃圾箱中
D.配制硫酸溶液时,用量筒量取一定体积的浓硫酸慢慢倒入烧杯中的水里,充分搅拌后迅速转移到容量瓶里
参考答案:A
本题解析:SO2污染空气,要进行尾气处理;白磷易自燃,溶于CS2后倒入垃圾箱易引起火灾,另外CS2是易挥发的有毒物质;浓硫酸稀释后要冷却至室温再转入容量瓶。
本题难度:简单