时间:2019-06-28 22:13:28
1、计算题 实验室用二氧化锰和浓盐酸反应制取氯气。
(1)若用200mL 10mol·L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化挥发),则产生氯气的物质的量为 0.50mol(填“大于”、“等于”或“小于”),原因是 。
(2)8.7g二氧化锰与足量的浓盐酸反应,则被氧化的氯化氢的物质的量是多少?产生的氯气在标准状况下的体积是多少?
参考答案:(8分)(1)小于 加热过程浓盐酸中HCl挥发掉部分;随着反应进行,浓盐酸变稀,稀盐酸不与二氧化锰反应。(2)被氧化的氯化氢的物质的量为0.2 mol,产生的氯气在标准状况下的体积是2.24L
本题解析:(1)盐酸的物质的量是0.2L×10mol/L=2mol,由于过程浓盐酸中HCl挥发掉部分;随着反应进行,浓盐酸变稀,稀盐酸不与二氧化锰反应,所以根据方程式MnO2 + 4H+ + 2Cl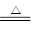 Mn2+ + 2H2O + Cl2↑可知,产生氯气的物质的量为小于0.50mol。
Mn2+ + 2H2O + Cl2↑可知,产生氯气的物质的量为小于0.50mol。
(2)8.7g二氧化锰的物质的量是8.7g÷87g/mol=0.1mol,则根据方程式可知
MnO2 + 4HCl(浓)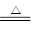 MnCl2+ 2H2O + Cl2↑
MnCl2+ 2H2O + Cl2↑
1mol 4mol 22.4L
0.1mol 0.4mol 2.24L
所以被氧化的氯化氢的物质的量是0.4mol÷2=0.2mol
产生的氯气在标准状况下的体积是2.24L
考点:考查浓盐酸和二氧化锰反应的有关计算
点评:该题是中等难度的试题,试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑思维能力和发散思维能力。该的关键是明确稀盐酸不能被二氧化锰氧化,然后具体问题、具体分析即可。
本题难度:一般
2、计算题 (6分)取17.3g的NH4Cl和(NH4)2SO4固体混合物,加水完全溶解后,加入50mL的BaCl2溶液,恰好反应完得到11.65g的白色沉淀,试计算固体混合物中NH4Cl的物质的量和BaCl2溶液的物质的量浓度。
参考答案:0.2mol,? 1mol/L
本题解析:略
本题难度:一般
3、选择题 有一种黄棕色气体X,其体积为20毫升,完全分解后生成10毫升的氯气和20毫升氧气(同温同压下测定),判断X为三原子分子依据的定律是(? )
①质量守恒定律?②能量守恒定律?③能量最低原理?④阿伏加德罗定律
A.①②
B.①④
C.②③
D.②④
参考答案:B
本题解析:由阿伏加德罗定律可知,在一定温度和压强下,气体的体积之比等于物质的量之比,则有:2X=Cl2+2O2,化学反应遵循质量守恒定律,则X的化学式为ClO2,为三原子分子,选A。
本题难度:一般
4、选择题 在同温同压下,11.5 g气体A所占的体积和8 g O2所占的体积相同,则气体A的相对分子质量为( )
A.46
B.28
C.44
D.64
参考答案:A
本题解析:8gO2的物质的量为8g/32g/mol=0.25mol,同温同压下,二者体积相同,则11.5g气体A和8gO2的物质的量相同,即气体A的物质的量为0.25mol;所以气体A的摩尔质量为11.5g/0.25mol=46g/mol.所以该气体的相对分子质量为46.故选:A.
考点:考查阿伏伽德罗定律及推论的计算
本题难度:一般
5、选择题 标准状况下,mg气体A与ng气体B所含分子数相同,下列说法不正确的是(?)
A.A与B相对分子质量之比为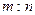
B.同质量的A与B所含分子数之比为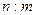
C.相同状况下,同体积的A与B的质量之比为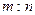
D.标准状况下,A与B的密度之比为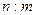
参考答案:D
本题解析:略
本题难度:简单