时间:2019-06-28 22:10:03
1、选择题 已建立平衡的某可逆反应,当条件改变化学平衡正向移动时,下列叙述正确的是
①生成物的体积分数一定增大 ②生成物的产量一定增加 ③生成物的产率一定增大
④反应物浓度一定降低 ⑤正反应速率一定大于逆反应速率 ⑥混合气体平均分子量一定增大
A.①②③
B.①④⑤
C.②⑤
D.②④⑤
参考答案:C
本题解析:平衡向正反应方向移动,则正反应速率一定大于逆反应速率,生成物的产量一定增加,②⑤正确,其余都是不一定的,答案选C。
本题难度:简单
2、选择题 可逆反应aA(s) + bB(g) cC(g) + dD(g),△H="Q" kJ/mol,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(P)的关系如图所示,据图分析,以下正确的是
cC(g) + dD(g),△H="Q" kJ/mol,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(P)的关系如图所示,据图分析,以下正确的是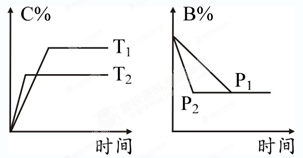
A.T1>T2,Q>0
B.Tl<T2,Q>0
C.P1>P2,a+b=c+d
D.Pl<P2,b=c+d
参考答案:D
本题解析:根据图像可知,曲线T2首先达到平衡状态,所以T2大于T1。温度高,C的含量低,所以升高温度平衡向逆反应方向移动,则正反应是放热反应,Q小于0;根据图2可知,P2首先达到平衡状态,所以P2大于P1,但改变压强,平衡不移动,所以反应前后气体的体积不变,则b=c+d,所以答案选D。
本题难度:一般
3、计算题 (12分)氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点—54.1℃,沸点69.1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g) SO2Cl2(l)?△H=—97.3kJ/mol
SO2Cl2(l)?△H=—97.3kJ/mol
⑴为了提高上述反应中Cl2的平衡转化率,下列措施合理的是?(用编号填空)。
A.缩小容器体积
B.使用催化剂
C.增加SO2浓度
D.升高温度
(2)300℃时,体积为1 L的密闭容器中充入16.20 g SO2Cl2,达到平衡时容器中含SO2 7.616 g,则300℃时合成SO2Cl2反应的平衡常数为?。
(3)已知某温度下,已知Ksp(AgCl)=2.0×10-10,Ksp(Ag2SO4)=1.6×10-5,在SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液,当Ag+浓度为0.1mol/L时,浑浊液中Cl-浓度与SO42-浓度之比为?。
⑷将(2)所得的平衡混合气溶于足量的BaCl2溶液中,计算最终生成沉淀的质量是多少(写出计算过程)。
参考答案:⑴AC? ⑵0.0706? (3分)? (3) 1.25×10-6 (3分)
⑷SO2Cl2+2H2O=H2SO4+2HCl? SO2+Cl2+2H2O=H2SO4+2HCl? H2SO4+BaCl2=BaSO4?↓+2HCl
由S元素质量守恒,可得:BaSO4的物质的量为0.12mol
质量为:0.12mol×233g/mol=27.96g? (4分)
本题解析:(1)缩小容器体积,则气体浓度增大,即压强增大,平衡正向移动,能提高Cl2的平衡转化率;使用催化剂,不影响平衡移动,则不能提高Cl2的平衡转化率;增加SO2浓度,平衡正向移动,能提高Cl2的平衡转化率;升高温度,平衡逆向移动,Cl2的平衡转化率减小;
(2)?SO2(g)+Cl2(g) SO2Cl2(l)
SO2Cl2(l)
C(初始)? 0? 0? 0.12
△C? 0.119? 0.119? 0.119
C(平衡) 0.119? 0.119? 0.001
平衡常数K=0.001mol.L-1/(0.119 mol.L-1×0.119 mol.L-1)= 0.0706(mol.L-1)-1;
(3)? AgCl(S) ?Ag+(aq)+Cl-(aq)?
?Ag+(aq)+Cl-(aq)?
Ksp(AgCl)=2.0×10-10=[Ag+][Cl-],则[Cl-]=2.0×10-9 mol.L-1
Ag2SO4(S)  ?2Ag+(aq)+SO42-( aq)
?2Ag+(aq)+SO42-( aq)
Ksp(Ag2SO4)=1.6×10-5=[Ag+]2[SO42-] ,则[SO42-]= 1.6×10-3mol.L-1
故[Cl-]:[SO42-]=1.25×10-6
本题难度:简单
4、选择题 某温度下,某容积恒定的密闭容器中发生如下可逆反应:
CO(g)+H2O(g) H2(g)+CO2(g)△H>0。当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是
H2(g)+CO2(g)△H>0。当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是
A.升高温度
B.加入催化剂
C.再加入n molCO和n molH2O
D.再加入2n molCO2和2n molH2
参考答案:D
本题解析:该反应为反应前后气体的体积相等,压强不影响化学平衡移动。A、升高温度,平衡向正反应方向移动,但反应物不可能完全转化为生成物,所以氢气的物质的量浓度不可能增大1倍,故A错误;B、催化剂只是改变反应速率,不影响转化率,故B错误;C、再通入nmolCO2和nmolH2,平衡向逆反应方向移动,有部分氢气减少,所以氢气的物质的量浓度不可能是增大1倍,故C错误;D、再通入2nmol CO和2nmolH2O(g),平衡向正反应方向移动,当再次达到平衡状态时,氢气的物质的量浓度能增大1倍,故D正确,故答案选D。
本题难度:一般
5、选择题 在5 mL 0.1 mol·L-1 KI溶液中滴加0.1 mol·L-1 FeCl3溶液5~6滴后,再进行下列实验,其中可证明FeCl3与KI的反应是可逆反应的实验(含现象)是( )
A.滴加AgNO3溶液,有黄色沉淀产生
B.加入CCl4振荡,下层液体为浅紫色
C.加入CCl4振荡,下层液体为浅紫色;取上层清液,滴加AgNO3溶液,有白色沉淀产生
D.加入CCl4振荡,下层液体为浅紫色;取上层清液,滴加KSCN溶液,溶液显红色
参考答案:D
本题解析:依据方程式2I-+2Fe3+ I2+2Fe2+可知I-过量,只要证明溶液中含有Fe3+即可证明该反应为可逆反应
I2+2Fe2+可知I-过量,只要证明溶液中含有Fe3+即可证明该反应为可逆反应
本题难度:一般