时间:2019-06-28 22:08:42
1、实验题 实验室配制500ml 0.1 mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取碳酸钠粉末____________g。
(2)配制时应选用的仪器有500ml容量瓶,托盘天平、烧杯、药匙、___________。
(3)配制时,该实验两次用到玻璃棒,其作用分别是___________、___________。
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
①没有洗涤烧杯和玻璃棒___________。
②如果加水超过了刻度线,取出水使液面恰好到刻度线___________。
③容量瓶没有干燥___________。
参考答案:(1)5.3
(2)玻璃棒、胶头滴管
(3)搅拌;引流
(4)①偏低;②偏低;③无影响
本题解析:
本题难度:一般
2、选择题 把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为 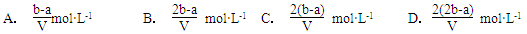
参考答案:D
本题解析:消耗氢氧化钠是amol,则每一份溶液中镁离子是0.5amol;消耗氯化钡是bmol,所以每一份中SO42-是bmol,则硫酸钾的物质的量是(b-0.5a)mol,所以每一份中钾离子的物质的量是(2b-a)mol,浓度是(2b-a)mol÷0.5VL,答案选D。
本题难度:一般
3、选择题 将30.0mL0.5mol/LNaOH溶液加水稀释到500.0mL,稀释后溶液中NaOH的物质的量
浓度为
A.0.03mol/L
B.0.04mol/L
C.0.05mol/L
D.0.3 mol/L
参考答案:A
本题解析:令稀释后溶液中NaOH的物质量浓度为c,则:30×10-3L×0.5mol/L=500×10-3L×c
解得c=0.03mol/L。
考点:物质的量浓度的相关计算
本题难度:一般
4、填空题 已知A、B两元素的单质气体在同温、同压下能以2∶1体积完全化合成C气体,且反应后的气体比反应前气体体积减少1/3。试证明B元素的单质气体一定不是单原子分子:______________________________________________________________。
参考答案:2Ax+By====2AxB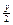 ,得
,得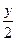 ≥1,故y≥2,所以B元素的单质气体一定不是单原子分子
≥1,故y≥2,所以B元素的单质气体一定不是单原子分子
本题解析:设A、B气体化学式分别为Ax、By,由题意及质量守恒定律得2Ax+By?====2AxB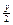 ,得
,得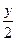 ≥1,故y≥2。
≥1,故y≥2。
本题难度:简单
5、选择题 将标准状况下的a L HCl(g)溶于1000g水中,得到的盐酸密度为b g·cm-3,则该盐酸的物质的量浓度是 mol·L-1
A.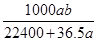
B.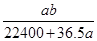
C.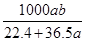 mol·L-1
mol·L-1
D.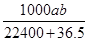
参考答案:D
本题解析:溶液的质量等于HCl和水的质量之和,溶质量为:(36.5a/22.4+1000)g,溶液的体积为(36.5a/22.4+1000)g÷b g·cm-3="(36.5a+22400)/22.4b" mL=[(36.5a+22400)×10-3] /22.4b L,该盐酸的物质的量浓度为(a/22.4)÷[(36.5a+22400)×10-3] /22.4b ="1000ab/(22400+36.5)" mol·L-1
考点:物质的量浓度的计算。
本题难度:一般