时间:2019-06-28 22:08:42
1、选择题 设NA为阿佛加德罗常数的数值,下列说法正确的是( )
A.78 g Na2O2中含有的阴离子数为2NA
B.1.0 L 1.0 mo1/L的NaAlO2水溶液中含有的氧原子数为2NA
C.8.2 g Na218O2与足量的CO2和H2O(g)的混合气体充分反应后转移电子数为0.1NA
D.NA个Fe(OH)3胶体粒子的质量为107g
参考答案:C
本题解析:A.78 g Na2O2中含有的阴离子数为NA个过氧根,错误;B还有水中的氧原子,错误;C.8.2 g Na218O2是0.1mol,与足量的CO2和H2O(g)的混合气体充分反应后转移电子数为0.1NA,正确;D.NA个Fe(OH)3胶体粒子的质量大于107g,错误;
本题难度:一般
2、填空题 配制100mL0.5mol/L的CuSO4溶液
(1)需用胆矾质量为______
(2)配制方法:设计五个操作步骤:
①向盛有胆矾的烧杯中加入20mL水使其溶解;②继续往容量瓶中加水至液面接近刻度线2cm~3cm;③将CuSO4溶液沿玻璃棒注入50mL容量瓶中;④在烧杯中加入量的水,小心洗涤2~3次后移入容量瓶;⑤改用胶头滴管加水至刻度线,加盖摇匀
试用以上操作编出正确顺序______
(3)a.定容时俯视刻度线;b.定容时仰视刻度线;c.所使用的容量瓶事先用某种浓度的CuSO4溶液润洗过;d.定容时加盖摇匀,装入用蒸馏水洗净的试剂瓶其中使实验结果偏高的有哪些:______.
参考答案:(1)CuSO4的物质的量n=cV=0.1L×0.5mol?L-1=0.05mol,Na2CO3?10H2O的物质的量等于Na2CO3的物质的量,所以Na2CO3?10H2O的质量0.05mol×250g/mol=12.5g,故答案为:12.5g;
(2)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀,故答案为:①③④②⑤;
(3)a.定容时俯视刻度线,溶液的体积偏小,浓度偏大,故a正确;
b.定容时仰视刻度线,溶液的体积偏大,浓度偏小,故b错误;
c.所使用的容量瓶事先用某种浓度的CuSO4溶液润洗过,溶质的质量偏大,浓度偏大,故c正确;
d.定容时加盖摇匀,装入用蒸馏水洗净的试剂瓶,对配制的溶液进行了稀释,浓度偏小,故d错误;
故答案为:a、c.
本题解析:
本题难度:一般
3、选择题 与1.8 g H2O含有相同氧原子数的H2SO4为
A.2.45 g
B.4.9 g
C.0.1 g
D.0.2 g
参考答案:A
本题解析:氧原子数相同即氧原子的物质的量相等;1.8 g H2O的物质的量为0.1mol,氧原子的物质的量为0.1mol;则含0.1mol氧原子的H2SO4的物质的量不0.025mol,其质量为2.45 g;
本题难度:一般
4、选择题 下列说法中正确的是( )
A.将0.1molCuSO4?5H2O晶体加入到100mL水中,该溶液物质的量浓度为1mol?L-1
B.一定体积的浓硫酸(其中含0.2molH2SO4)与足量的铜共热反应,生成SO2气体0.1mol
C.将34.2gAl2(SO4)3溶于水配成100mL溶液[Al2(SO4)3的相对质量为342J,取出10mL该溶液中Al3+浓度为1mol?L-1
D.KCl溶液的密度为1.174g?cm-3,物质的量浓度为4.0mol?L-1,则此溶液中KCl的质量分数为
| 74.5×4.0 1.174×1000 |
参考答案:A.将0.1molCuSO4?5H2O晶体溶于水配成100mL溶液,溶液物质的量浓度为1mol?L-1,物故A错误;
B.Cu与浓硫酸反应,随反应进行,浓硫酸变稀,而稀硫酸不与Cu反应,由Cu+2H2SO4(浓)△.CuSO4+SO2↑+2H2O可知,含0.2molH2SO4的浓硫酸与足量的铜共热反应,生成SO2气体小于0.1mol,故B错误;
C.34.2gAl2(SO4)3的物质的量为0.1mol,于水配成100mL溶液,所得Al2(SO4)3溶液浓度为1mol/L,溶液时均匀的,取出10mL溶液的浓度与原溶液浓度相等,由于Al3+水解,其浓度小于2mol/L,故C错误;
D.KCl溶液的密度为1.174g?cm-3,物质的量浓度为4.0mol?L-1,根据c=1000ρWM可知,此溶液中KCl的质量分数为74.5×4.01.174×1000×100%,故D正确,
故选D.
本题解析:
本题难度:一般
5、计算题 某课外兴趣小组对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应。实验数据如下表:
| ? | 甲 | 乙 | 丙 |
| 烧杯+稀硫酸 | 200 g | 150 g | 150 g |
| 加入的铁样品 | 9 g | 9 g | 14 g |
| 充分反应后,烧杯+剩余物 | 208.7 g | 158.7 g | 163.7 g |
参考答案:(1)乙? (2)93.3%? (3)17.1%
本题解析:(1)甲、乙、丙均产生0.3 g H2,甲可看作是在乙的基础上再加50 g H2SO4,丙可看作是在乙的基础上再加5 g铁,均未再多产生气体,说明乙中H2SO4与铁恰好完全反应。
(2)由乙组数据计算:
Fe+H2SO4====FeSO4+H2↑
56? 2
m(Fe)? 0.3 g
m(Fe)=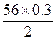 g="8.4" g
g="8.4" g
样品中铁的质量分数w(Fe)=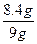 ×100%=93.3%
×100%=93.3%
(3)Fe+H2SO4====FeSO4? +? H2↑
152? 2
m(FeSO4)? 0.3 g
m(FeSO4)=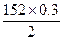 g="22.8" g
g="22.8" g
w(FeSO4)=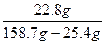 ×100%=17.1%
×100%=17.1%
本题难度:简单