时间:2019-06-28 22:08:20
1、选择题 已知几种难溶电解质的溶度积常数(25℃)见下表 
下列对AgCl、AgBr、AgI、Ag2SO4、Ag2CrO4叙述不正确的是
[? ]
A.Ksp的大小与三种卤化银见光分解的难易无关
B.将等体积的4×10-3 mol·L-1的AgNO3和4×10-3 mol·L-1 K2CrO4混合,有Ag2CrO4沉淀产生
C.向AgCl的悬浊液中滴加NaI的饱和溶液可以得到黄色AgI悬浊液
D.向100mL0.1mol·L-1的Na2SO4溶液中加入1mL0.1mol·L-1的AgNO3溶液,有白色沉淀生成
参考答案:D
本题解析:
本题难度:一般
2、选择题 在溶液中有浓度均为0.01mol/L的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:Ksp[Fe(OH)3]=2.6×10-39; Ksp[Cr(OH)3] =7.0×10-31 Ksp[Zn(OH)2] =1.0×10-17; Ksp[Mg(OH)2] =1.8×10-11当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小
[? ]
A.Fe3+
B.Cr3+
C.Zn2+
D.Mg2+
参考答案:A
本题解析:
本题难度:一般
3、选择题 自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是?
[? ]
A.CuS的溶解度大于PbS的溶解度
B.原生铜的硫化物具有还原性,而铜蓝没有还原性
C.CuSO4与ZnS反应的离子方程式是Cu2+ + S2-=CuS↓
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
参考答案:D
本题解析:
本题难度:一般
4、填空题 活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO):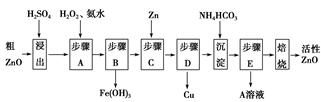
已知:几种离子生成氢氧化物沉淀时的pH如表:
| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
参考答案:(1)2Fe2++H2O2+2H+=2Fe3++2H2O 3.2~5.2 (2)(NH4)2SO4 (3)> (4)0.78
本题解析:(1)步骤A加入H2O2的目的是将Fe2+氧化为Fe3+便于除去,同时不引入新的杂质。由流程图看出该步操作只生成Fe(OH)3沉淀,结合表中数据可知需控制溶液pH为3.2~5.2之间。
(2)硫酸锌溶液中加入碳酸氢铵后生成碱式碳酸锌沉淀和硫酸铵。
(3)反应自发,且ΔH>0,则ΔS必大于0。
(4)由c(Zn2+)×c2(OH-)=Ksp
c(Zn2+)=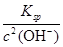 =
=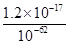 =1.2×10-5(mol·L-1),即1.2×10-5 mol·L-1×65 g·mol-1=7.8×10-4g·L-1,即0.78 mg·L-1
=1.2×10-5(mol·L-1),即1.2×10-5 mol·L-1×65 g·mol-1=7.8×10-4g·L-1,即0.78 mg·L-1
本题难度:一般
5、选择题 下表提供的玻璃仪器(非玻璃仪器任选)及现象描述均符合相应实脸目的的是
| 选项 | 实验目的 | 玻璃仪器 | 实验现象 |
| A | 硫化锌沉淀转化为硫化铜沉淀 | 试管、胶头滴管 | 白色沉淀转化为黑色沉淀 |
| B | 验证CO2的氧化性 | 酒精灯、集气瓶、玻璃片 | 镁条剧烈燃烧,产生白色的烟雾,瓶内壁有白色粉末 |
| C | 分离乙酸乙酯与乙酸 | 分液漏斗、烧杯 | 液体分层,上层为无色油状液体,上层液体和下层液体都从分液漏斗下口放出 |
| D | 实验室制取乙烯 | 酒精灯、圆底烧瓶、导管 | 加热后液体沸腾,液体逐渐变黑,并有气体产生 |
参考答案:A
本题解析:A.ZnS白色沉淀在溶液中存在沉淀溶解平衡:ZnS(s) Zn2+(aq)+S2-(aq),当向该溶液中滴加CuSO4溶液,由于c(Cu2+)?c(S2-)>Ksp(CuS),所以会转化为更难溶的CuS黑色沉淀,正确;B.镁条在CO2中剧烈燃烧,发出耀眼的白光,产生白烟,而不是白色烟雾,瓶内壁附有白色粉末和黑色颗粒,错误;C. 乙酸乙酯与乙酸是混溶的液体物质,向乙酸乙酯与乙酸中加入饱和碳酸钠溶液,振荡、静置、分液,上层的乙酸乙酯应从分液漏斗上口放出,错误;D.实验室制乙烯需将浓硫酸与乙醇混合加热170℃,因此需要的玻璃仪器中缺少温度计,错误。
Zn2+(aq)+S2-(aq),当向该溶液中滴加CuSO4溶液,由于c(Cu2+)?c(S2-)>Ksp(CuS),所以会转化为更难溶的CuS黑色沉淀,正确;B.镁条在CO2中剧烈燃烧,发出耀眼的白光,产生白烟,而不是白色烟雾,瓶内壁附有白色粉末和黑色颗粒,错误;C. 乙酸乙酯与乙酸是混溶的液体物质,向乙酸乙酯与乙酸中加入饱和碳酸钠溶液,振荡、静置、分液,上层的乙酸乙酯应从分液漏斗上口放出,错误;D.实验室制乙烯需将浓硫酸与乙醇混合加热170℃,因此需要的玻璃仪器中缺少温度计,错误。
考点:考查实验方案的设计的正误判断的知识。
本题难度:一般