时间:2019-06-28 22:08:00
1、选择题 在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是
A.CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(l)△H=+725.8 kJ/mol
B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)△H=-1452 kJ/mol
C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)△H=-725.8 kJ/mol
D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)△H=+1452 kJ/mol
参考答案:B
本题解析:放出热量在热化学方程式中以“—”表示,排除AD
在题设条件下可求得1 mol甲醇完全燃烧放出的热量为22.68kJ×32="725.8" kJ,而2 mol甲醇完全燃烧放出的热量为1452 kJ,故选项B符合题意
本题难度:一般
2、选择题 下列物质中,既含离子键又含非极性共价键的是?(?)
A.Na2O2
B.H2O
C.HClO
D.NaOH
参考答案:A
本题解析:活泼的金属与平衡的非金属容易形成离子键,非金属元素的原子之间容易形成共价键,如果是不同种非金属属于形成,则是极性键,由同种非金属元素形成则为非极性键,A、过氧化钠中含有钠离子与过氧根之间的离子键以及氧原子与氧原子之间的非极性键,A正确;B、水分子中只有极性键,B不正确;C、次氯酸分子中只有极性键,C不正确;D、氢氧化钠中含有离子键和极性键,D不正确,答案选A。
本题难度:一般
3、填空题 (12分)氯化铍是用于制有机铍化合物和金属铍的重要原料。
(1)BeCl2分子中组成元素Be的基态原子的价电子排布式为?,其元素的第一电离能?B元素(填“>”或“<” 或“=”),原因是?。
(2)已知BeCl2加热易升华,液态BeCl2不导电,BeCl2晶体类型为?; BeCl2中Be原子的杂化轨道类型是?。
(3)用阴离子树脂交换法提取一种组成元素为氯和铍的阴离子,该阴离子内铍原子达到8电子稳定结构,则该离子内存在的微粒间的作用力是?,阴离子的结构式为?。
参考答案:(1)2s2 (2分);?>?(1分);? Be的2s轨道全充满,体系能量低(2分)。?
(2)分子晶体(1分);? sp (2分)
(3)共价键和配位键?(2分) ; 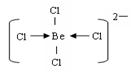 (2分)
(2分)
本题解析:(1)Be是第ⅡA元素,所以根据构造原理可知,Be原子的基态价电子排布式为2s2。非金属性越强,第一电离能越大,但由于Be的2s轨道全充满,稳定性强,体系能量低,所以第一电离能大于B的。
(2)根据BeCl2的物理性质可判断,形成的晶体应是分子晶体、BeCl2分子中心原子没有孤对电子,所以是直线型结构,采用sp杂化。
(3)阴离子内铍原子达到8电子稳定结构,说明分子内除了含有共价键以外,还一定存在配位键,即氯原子提供电子对,Be原子提供空轨道,结构式为 。
。
本题难度:一般
4、选择题 在25℃、1.01×105Pa时,1gCH4燃烧时生成CO2与液态H2O,放出55.6kJ的热量,则CH4的燃烧热为 ( )
A.55.6kJ/mol
B.444.8kJ/mol
C.889.6kJ/mol
D.-889.6kJ/mol
参考答案:D
本题解析:CH4的燃烧热是1molCH4完全燃烧的焓变,CH4的摩尔质量为16g/mol,所以16*55.6=889.6 甲烷燃烧,放出热量,焓变为负,D 正确。
本题难度:简单
5、选择题 在某一化学反应中,反应物A的浓度在15 s内从3.0 mol/L变成1.5 mol/L,在这15 s内A的化学反应速率为
A.1.5 mol/(L·s)
B.1.5 mol/L
C.0.1 mol/(L·s)
D.0.1 mol/L
参考答案:C
本题解析: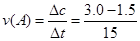 ="0.1" mol/(L·s)
="0.1" mol/(L·s)
本题难度:简单