时间:2019-06-28 22:04:29
1、填空题 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。 (1)合成氨反应反应N2(g)+3H2(g)
(1)合成氨反应反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡?移动(填“向左”“向右”或“不”);,使用催化剂?反应的ΔH(填“增大”“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡?移动(填“向左”“向右”或“不”);,使用催化剂?反应的ΔH(填“增大”“减小”或“不改变”)。 (2)O2 (g)= O+2(g)+e-?
(2)O2 (g)= O+2(g)+e-?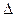 H1=" 1175.7" kJ·mol-1
H1=" 1175.7" kJ·mol-1 PtF6(g)+ e-1
PtF6(g)+ e-1 PtF6-(g)?
PtF6-(g)?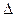 H2=" -" 771.1 kJ·mol-1
H2=" -" 771.1 kJ·mol-1 O2+PtF6-(s)=O2+(g)+PtF6- ?
O2+PtF6-(s)=O2+(g)+PtF6- ? H3="482.2" kJ·mol-1
H3="482.2" kJ·mol-1 则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的
则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的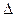 H="_____________" kJ·mol-1。
H="_____________" kJ·mol-1。 (3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。 (4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
参考答案:(1)向左 不改变 (2)-77.6 (3)Cu(OH)2?Cu2++2NH3·H2O=Cu(OH)2 ↓+2NH4+ (4)中? Kb=10-9/( (a-0.01)mol·L-1.
(4)中? Kb=10-9/( (a-0.01)mol·L-1.
本题解析:(1)在恒压条件下加入氩气,则容积增大,导致原平衡中各物质的浓度同等比例减小,所以平衡向气体体积增大的方向即向左移动;催化剂仅是改变化学反应速率,不会影响焓变。(2)根据盖斯定律,将化学方程式①+②-③叠加。(3)Cu(OH)2 的Ksp小于Mg(OH)2的,所以离子的浓度商首先大于Cu(OH)2 的而先沉淀;由于氨水是弱碱,书写离子方程式时不能拆开。(4)由溶液的电荷守恒可得: c(H*)+c(NH4*)=c(Cl-)+c(OH-),已知c(NH4*)=c(Cl-),则有c(H*)=c(OH-),溶液显中性;电离常数只与温度有关,则此时NH3·H2O的电离常数Kb= [c(NH4*)·c(OH-)]/c(NH3·H2O)=" (0.01" mol·L-1·10-7mol·L-1)/(amol·L-1-0.01 mol·L-1)= 10-9/( (a-0.01)mol·L-1.
本题难度:一般
2、选择题 下列说法正确的是
A.化学反应中的能量变化都表现为热量的变化
B.需要加热才能发生的反应一定是吸热反应
C.放热反应在常温下一定很容易发生
D.反应是吸热还是放热必须看反应物和生成物的总能量的大小
参考答案:D
本题解析:需要加热才能发生的反应不一定是吸热反应,放热反应不一定不需要加热。反应是吸热还是放热必须看反应物和生成物的总能量的大小。
本题难度:一般
3、实验题 (12分)(1)用50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题: 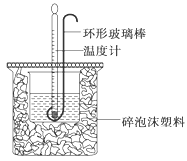
①烧杯间填满碎泡沫塑料的作用是 。
②若大烧杯上改为盖薄铁板,求得的反应热数值: (填“偏大”、“偏小”或“无影响”)
③若通过测定计算产生的热量为1.42kJ,请写该反应的热化学方程式: 。
(2)①已知:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
则以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为: 。
②由气态基态原子形成1 mol化学键释放的最低能量叫键能。已知表中所列键能数据, 则N2(g)+3H2(g) 2NH3(g) ΔH= kJ·mol-1。
2NH3(g) ΔH= kJ·mol-1。
| 化学键 | H—H | N—H | N≡N |
| 键能kJ·mol-1 | 436 | 391 | 945 |
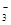 (aq)+2Cl-(aq)的ΔH= kJ·mol-1。
(aq)+2Cl-(aq)的ΔH= kJ·mol-1。
参考答案:(12分)(1)①保温(或隔热、或减少热量损失)(2分)
②偏小 (2分)
③ HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-56.8kJ·mol-1 (2分)
(2)①CH4(g)+2H2O(g)=== CO2(g)+ 4H2(g) ΔH=+165kJ·mol-1 (2分)
② -93 (2分)
③ -117 (2分)
本题解析:(1)①烧杯间填满碎泡沫塑料的作用是保温,减少热量的散失,减小实验误差;
②若大烧杯上改为盖薄铁板,铁板可以传热,热量损失较大,则测定的热量较少,结果偏小;
③若通过测定计算产生的热量为1.42kJ,即生成0.025mol水放出1.42kJ的热量,则生成1mol水放出的热量是1.42kJ/0.025mol=56.8kJ/mol,所以该反应的热化学方程式为HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-56.8kJ·mol-1;
(2)①根据盖斯定律,CH4(g)+2H2O(g)=== CO2(g)+ 4H2(g)的
ΔH=2×(+206.2 kJ·mol-1)-(+247.4 kJ·mol-1)=+165kJ·mol-1,所以CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:CH4(g)+2H2O(g)=== CO2(g)+ 4H2(g) ΔH=+165kJ·mol-1;
②根据ΔH=反应物的总键能-生成物的总键能得N2(g)+3H2(g) 2NH3(g) ΔH=(945+3×436-2×3×391)kJ/mol=-93kJ/mol;
2NH3(g) ΔH=(945+3×436-2×3×391)kJ/mol=-93kJ/mol;
③ClO-(aq)中的Cl元素的化合价是+1价,ClO-(aq)的能量是60,Cl-的化合价是-1价,能量是0,ClO3-中Cl的化合价是+5价,能量是63,根据ΔH=生成物的总能量-反应物的总能量得该费用的ΔH=63-3×60=-117kJ/mol。
考点:考查中和热的测定,热化学方程式的书写,化学反应热效应的计算,物质的键能、能量与热效应的关系
本题难度:困难
4、选择题 下列各组化合物中化学键类型不同的是( )
A.NaCl和HNO3
B.H2O和NH3
C.MgF2和NaCl
D.H2O和CO2
参考答案:A、NaCl为离子化合物且只含有离子键,而HNO3为共价化合物,含有共价键,化学键类型不同,故A正确;
B、H2O和NH3均为共价化合物,化学键类型相同,故B错误;
C、MgF2和NaCl均为离子化合物,化学键类型相同,故C错误;
D、CO2和H2O均为共价化合物,化学键类型相同,故D错误.
故选A.
本题解析:
本题难度:简单
5、填空题 由反应物粒子一步直接实现的化学反应称为基元反应。某化学反应是通过三步基元反应实现的:
①Ce4++Mn2+→Ce3++ Mn3+;②Ce4++ Mn3+→Ce3++Mn4+;③Ti++ Mn4+→Ti3++ Mn2+。
由此可知,该反应的催化剂是____,起始反应物是___,总反应的化学方程式为____。
参考答案:Mn2+ ? ;Ce4+和Ti+? ;2Ce4+ +Ti+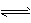 2Ce3+ +Ti3+
2Ce3+ +Ti3+
本题解析:
本题难度:一般