时间:2019-06-28 21:59:58
1、选择题 配制一定物质的量浓度的溶液时,由于不小心,使得液面超过了容量瓶的刻度(标线),这时应采取的措施是
A.小心吸出标线上的溶液;
B.重新配制;
C.影响不大,不需再处理;
D.估计超出标线溶液的体积,重新计算
参考答案:B
本题解析:配制一定物质的量浓度的溶液时,液面超过了容量瓶的刻度,说明实验失败,重新配制。
考点:考查物质的量浓度配制等相关知识。
本题难度:一般
2、选择题 设NA表示阿伏加德罗常数,下列说法正确的是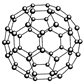
A.标准状况下1molHCl与HF的混合物的体积约为22.4L
B.N60结构如右图,28gN60单质中含有的N-N键个数为NA
C.1.72g生石膏(CaSO4·2H2O) 转化为熟石膏(2CaSO4·H2O) 失
去的结晶水数目为0.015NA
D.9 g重水所含有的电子数为5NA
参考答案:C
本题解析:阿伏加德罗常数正误判断题在注重对有关计算关系考查的同时,又隐含对某些概念理解的考查。试题计算虽然难度不大,但概念性强,区分度大,是每年高考的必考试题。选项A中,由于HF分子中存在氢键,在标准状况下呈液态,因此1molHCl与HF的混合物的体积应小于22.4L。选项B中,N60分子中所含N-N键的数目为60×3/2=90,因此28gN60单质中含有的N-N键个数为28×90/(14×60)=3NA。选项C中生石膏转化为熟石膏的化学方程式为:2[CaSO4·2H2O]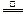 2CaSO4·H2O+3H2O,因此共失水0.015NA。9g重水的物质的量为
2CaSO4·H2O+3H2O,因此共失水0.015NA。9g重水的物质的量为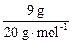 ="0.45" mol,其含有电子数为4.5NA。本题应选C。
="0.45" mol,其含有电子数为4.5NA。本题应选C。
本题难度:一般
3、填空题 等质量的氧气(O2)和臭氧(O3),物质的量之比为?,所含氧原子的个数之比为?
参考答案:3:2?、? 1:1
本题解析:根据n=m/M可知在质量相等的条件下,物质的量和摩尔质量成反比,即二者的物质的量之比是48︰32=3︰2。由于都是由氧原子形成的单质,所以所含氧原子的个数之比为1︰1。
本题难度:一般
4、选择题 设NA为阿伏加德罗常数的值,下列叙述正确的是?(?)
A.1 L 0.1 mol·L-1的CuCl2溶液中含Cu2+为0.1NA
B.标准状况下,22.4 L CCl4含CCl4分子为NA
C.1mol H3O+含质子数为10 NA
D.1molNa2O和Na2O2混合物中含阴离子的总数为NA
参考答案:D
本题解析:A错误,铜离子要水解,数量小于0.1NA
B错误,标准状况下CCl4是非气体物质,不能使用气体摩尔体积计算。
C错误,1mol H3O+含质子数11NA
D正确。
本题难度:一般
5、选择题 下列说法,你认为不可能的是
A.只用米汤就可以鉴定食盐是否加碘
B.一滴水中的分子数比全球人口还多
C.汽车尾气中含有氮的氧化物
D.可口可乐pH=2.2
参考答案:A
本题解析:
答案:A
A、不正确,食盐中加入的盐是KIO3,米汤中含有淀粉,遇到单质碘呈蓝色,要鉴定食盐是否加碘,要将KIIO3中的碘还原。
本题难度:简单