时间:2019-06-28 21:53:43
1、填空题 某同学按下列步骤配制100mL?1.00mol/LNaCl溶液.
①计算所需NaCl固体的质量
②称量NaCl固体
③将称好的NaCl固体放入烧杯中,用适量蒸馏水溶解
④将烧杯中的溶液注入容量瓶(已检查是否漏液),并用少量蒸馏水洗涤烧杯2~3次,洗涤液也注入容量瓶
⑤向容量瓶中加蒸馏水至距刻度线1~2cm处
⑥将容量瓶盖紧,振荡,摇匀
请回答有关问题:
(1)用托盘天平称量固体NaCl的质量为______g.
(2)为了加速溶解,可以采取的措施是______.
(3)使用容量瓶的规格是______?mL.
(4)该同学实验中明显缺少的一步操作是______.
(5)如果将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,最后配成的溶液中溶质的实际浓度比所要求______(填“大”或“小”)了.
2、选择题 精确配制一定物质的量浓度的NaOH溶液,下面实验操作中,正确的是( )
A.将烧杯中已冷却的NaOH溶液转移到未经干燥的容量瓶中
B.将称好的NaOH固体放入容量瓶中,加入少量水溶解
C.在烧杯中溶解NaOH固体后,立即将所得溶液注入容量瓶中
D.称量时,将NaOH固体直接放在天平托盘上面的纸上
3、简答题 实验室用固体烧碱配制500mL1mol/LNaOH溶液.
(1)需称量______g的烧碱固体,固体应放在______中称量.
(2)配制过程中,不需要使用的仪器是(填写代号)______.
A烧杯B量筒C1000mL容量瓶D玻璃棒E漏斗F胶头滴管G500mL试剂瓶
(3)根据实验的实际需要和(2)中列出的仪器判断,完成实验还缺少的仪器是______;
(4)在定容的过程中,后期加入少量水的做法是______.
4、选择题 配制0.1 mol/L的NaCl溶液,下列操作会导致所配溶液浓度偏高的是
[? ]
A.称量时,左盘高,右盘低
B.定容时俯视读取刻度
C.容量瓶洗净后未干燥
D.定容时液面超过了刻度线
5、简答题 工业上利用某合金废料(含铁、铜、碳)为原料制备CuSO4和(NH4)2SO4?FeSO4?6H2O(莫尔盐)的工艺流程如下: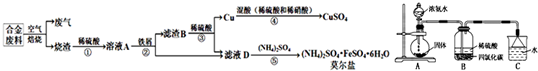
回答下列问题:
(1)实验室用容量瓶配制一定物质的量浓度的稀硫酸,定容时若俯视刻度线,则会导致配制的溶液浓度______(填“偏大”、“偏小”或“无影响”).
(2)步骤②和步骤③中会产生同一种气体,生成该气体的离子方程式为:______.
(3)用Cu和混酸(稀硫酸、稀硝酸)制备CuSO4溶液时,为得到纯净的CuSO4溶液,混酸中硫酸和硝酸的浓度之比最好为______.
(4)浓度均为0.1mol?L-1的莫尔盐溶液和(NH4)2SO4溶液中,c(NH4+)前者大于后者,原因是______.
(5)莫尔盐比绿矾(FeSO4?7H2O)更稳定,常用于定量分析.利用莫尔盐溶液可将酸性KMnO4还原为Mn2+,反应的离子方程式为:______.
(6)某化学兴趣小组设计用如图所示装置制备(NH4)2SO4溶液.
①装置A圆底烧瓶中的固体试剂为______(填试剂名称).
②将装置B中两种液体分离开,所需的最主要的玻璃仪器为______(填仪器名称).
③装置C的作用为______.