时间:2019-06-28 21:47:24
1、计算题 将一生锈的铁片置于稀硝酸中,反应结束后,共收集11.2L NO气体(标况)。溶液中还剩下固体残渣5g,过滤后向浅绿色溶液中通入35.5g氯气,恰好使Fe2+全部氧化,求原铁片的质量和铁锈的百分含量(铁锈成分以Fe2O3计算)。(保留两位小数)
2、选择题 将一浅绿色溶液,置于空气中,变黄色。将此黄色溶液逐滴滴入沸水中,
形成一种红褐色胶体,下列说法中错误的是( )
A.该浅绿色溶液中含有Fe2+,在空气中被氧化为Fe3+
B.欲检验该黄色溶液中是否含有未被氧化的Fe2+,向其中滴加KSCN溶液
C.配制该浅绿色溶液,要向其中加少量酸与铁粉,目的是为了防止Fe2+的水解与氧化
D.欲检验浅绿色溶液中是否含有Fe3+,滴入KSCN溶液,看是否变红色
3、填空题 以硫铁矿烧渣(含有氧化铁和少量硫化亚铁、二氧化硅等)为原料制备聚铁{可表示为Fe2(OH)n(SO4)3-n/2,和绿矾(FeSO4.7H2O)具有成本低、反应快、产品质量高等优点。制备流程如下图: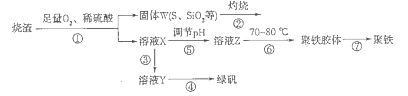
(1)流程图中溶液X为Fe(SO4)3,溶液,据此写出操作①中属于氧化还原反应的离子方程式:____________。
(2)操作②的处理存在弊端,该弊端是_____________。若固体W与KOH溶液昆合加热,其中一个反应的化学方程式为3S+6KOH 2K2S+K2SO3+3H2O,该反应的氧化剂与还原剂质量之比为___________。
2K2S+K2SO3+3H2O,该反应的氧化剂与还原剂质量之比为___________。
(3)操作③需要加入的物质(试剂)是_________,目的是___________________________。
(4)操作⑤是使溶液pH___________(填“增大”或“减小”)。
(5)操作⑥控制温度为70 -80℃的目的是_________________________________________ 。
(6)双氧水在酸性环境(硫酸)中是一种强氧化剂,可以将硫酸亚铁氧化成三价铁,制得Fe2(OH)n(SO4)3-n/2,反应的化学方程式为_________________________ _________。
4、选择题 已知氯化铁溶液中通入硫化氢可发生反应:2FeCl3+H2S→2FeCl2+S↓+2HCl。在标准状况下,向? 100mLFeCl3溶液中通入aL的H2S气体恰好反应后,再加入足量的铁粉充分反应。所得溶液经测定金属阳离子的浓度为3mol/L,若反应过程中溶液体积不变,则原FeCl3溶液的物质的量浓度为?(?)
A.1.5mol/L
B.2moi/L
C.lmol/L
D.无法确定
5、选择题 部分氧化的Fe—Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:
下列说法正确的是
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.V=224
C.样品中CuO的质量为4.0g
D.V=448