时间:2019-06-28 21:46:00
1、选择题 某同学根据原电池原理设计了“苹果电池”(如图),下列有关说法中正确的是( )
A.苹果里有电解质溶液
B.铁片是此“苹果电池”的正极
C.将苹果换成番茄,小灯泡就不亮了
D.一段时间后取出Cu片,其质量减少
参考答案:A、两个电极插入苹果,灯泡发亮,说明形成了原电池反应,苹果中有电解质溶液,故A正确;
B、铁和铜做原电池电极,铁做负极,故B错误;
C、番茄中也含有电解质溶液,灯泡也会发亮,故C错误;
D、铜片做原电池正极,不反应,质量不变,故D错误;
故选A.
本题解析:
本题难度:简单
2、选择题 下列关于原电池的叙述正确的是
[? ]
A.原电池将化学能转化为电能
B.原电池负极发生的反应是还原反应
C.原电池在工作时其正极不断产生电子并经过外电路流向负极
D.原电池的电极只能由两种不同的金属构成
参考答案:A
本题解析:
本题难度:简单
3、选择题 (2004年江苏高考化学题)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
参考答案:A、根据总反应可知Zn被氧化,为原电池的负极,故A正确;
B、根据电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),可知反应中Zn被氧化,
为原电池的负极,负极反应为Zn-2e-+2OH-═Zn(OH)2,MnO2为原电池的正极,发生还原反应,正极反应为
2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq),故B正确;
C、原电池中,电子由负极经外电路流向正极,故C错误;
D、负极反应为Zn-2e-+2OH-═Zn(OH)2,外电路中每通过O.2mol电子,消耗的Zn的物质的量为0.1mol,质量
为0.1mol×65g/mol=6.5g,故D正确.
故选C.
本题解析:
本题难度:一般
4、选择题 一种新型燃料电池,是用两根金属铂作电极插入KOH溶液中,然后向两极上分别通入H2和O2,下列说法不正确的是( )
A.通入H2的电极为负极
B.通入O2的一极电极反应为2H2O+O2+4e-4OH-
C.随着放电的进行,负极附近pH上升
D.标准状况下通入5.6LO2完全反应后有1mol电子转移
参考答案:A、氢氧燃料电池中通入氢气的一极为原电池的负极,故A正确;
B、氢氧燃料电池中通入氧气的一极为原电池的正极,发生还原反应,在碱性电解质环境下的电极反应为:2H2O+O2+4e-4OH-,故B正确;
C、碱性氢氧燃料电池中,电池的负极反应为2H2+2OH-=2H2O+2e-,因为消耗氢氧根离子,导致负极附近pH下降,故C错误;
D、氢氧燃料电池总反应为2H2+O2=2H2O,参加反应的氧气的物质的量是1mol时,转移电子是4mol,通入5.6L即0.25molO2完全反应后有1mol电子转移,故D正确.
故选C.
本题解析:
本题难度:简单
5、填空题 氮是地球上含量丰富的一种元素,氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
Ⅰ.(1)N2H4中的N原子最外层达到8电子稳定结构,写出N2H4的结构式_____________。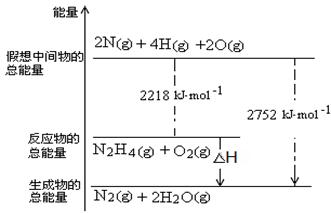
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为?。
(3)肼是一种高能燃料,有关化学反应的能量变化如右图所示,写出肼燃烧的热化学方程式?。
Ⅱ.氨的合成是最重要的化工生产之一。已知:
N2(g)+3H2(g) 2NH3(g)ΔH=-92.4 kJ·mol-1
2NH3(g)ΔH=-92.4 kJ·mol-1
在3个体积均为2L的密闭容器中,在相同的温度下,使用相同的催化剂合成氨,实验测得反应在起始、达到平衡时的有关数据如下表所示:?
试回答:
(1)下列各项能说明该反应已达到平衡状态的是______________(填写序号字母)。
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)分析上表数据,下列关系正确的是_________(填写序号字母)。
A.2c1>1.5mol·L-1
B.w3=w1
C.2ρ1=ρ2
D.K甲= K乙= K丙
(3)容器乙中反应从开始到达平衡平均速率为v(H2)= _____________。
III.直接供氨式碱性燃料电池的电池反应式是4NH3+3O2=2N2+6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是__________?。
参考答案:Ⅰ.(1) (1分)
(1分)
(2) 2NH3+NaClO=N2 H4+NaCl+H2O(2分)
(3)N2 H4(g) + O2(g) = N2(g) + 2H2O(g ) ΔH=-534 kJ·mol-1(2分)
Ⅱ.(1)C(2分)
(2)A C D(3分)
(3)0.3 mol·L-1·min-1(2分)
III.2NH3 + 6OH- + 6e- = N2 + 6H2O(2分)
本题解析:Ⅰ.(1)N2H4中的N原子可达到8电子的稳定结构,氮原子最外层3个电子形成三对共用电子对,和未成键的一对电子形成8电子稳定结构,每个氮原子和两个氢原子形成共价键,氮原子间形成一个共价键,结构式为: ,故答案为:
,故答案为: ;
;
⑵NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为:2NH3+NaClO=N2 H4+NaCl+H2O,答案:2NH3+NaClO=N2 H4+NaCl+H2O;⑶从图中读出,△H=22218kJ·mol-1-2752kJ·mol-1=-534 kJ·mol-1,所以肼燃烧生成气态水的热化学方程式为:N2 H4(g) + O2(g) = N2(g) + 2H2O(g ) ΔH=-534 kJ·mol-1,答案:N2 H4(g) + O2(g) = N2(g) + 2H2O(g ) ΔH=-534 kJ·mol-1;
Ⅱ.⑴A、应用速率之比来判断,反应过程中按照比例进行反应,故A不能判断该反应达到化学平衡状态;B、按照速率之比等于系数之比,表述的是正反应速率,当某种物质的正反应速率和逆反应速率相等是表明反应达到平衡,所以当3v(N2)正=v(H2)逆?时反应达到平衡,故B不能判断该反应达到化学平衡状态;C、当容器内压强保持不变,说明反应达到平衡,故C能判断该反应达到化学平衡状态;反应体系内质量守恒,体积一定,故混合气体的密度不变,所以混合气体的密度保持不变,不能说明反应达到平衡,故D不能判断该反应达到化学平衡状态;答案:C。
⑵A、正确,先用1.5L的容器进立与乙等效平衡,然后放大到3L,平衡向生成N2的方向即逆方向移动,所以2c1>1.5?mol·L?―1;?B、不正确,丙等效于3molH2,1molN2从正确向建立平衡,甲多加了1molN2,平衡正向移动;C、正确,反应体系内质量守恒,体积一定,混合气体的总质量甲是乙的2倍,所以混合气体的密度,2ρ1=ρ2;D、正确,温度不变,平衡常数不变,K甲= K乙= K丙。答案:A C D。
⑶v(H2)= 3v(N2)= ?,答案:0.3 mol·L-1·min-1;
?,答案:0.3 mol·L-1·min-1;
III.NH3作还原剂,生成1molN2失去6mol电子,用OH―调节使方程式两边电荷守恒,负极反应,2NH3 + 6OH- + 6e- = N2 + 6H2O,答案:2NH3 + 6OH- + 6e- = N2 + 6H2O
本题难度:一般