时间:2019-06-28 21:44:13
1、选择题 通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。则下列热化学方程式不正确的是

[? ]
参考答案:C
本题解析:
本题难度:一般
2、填空题 (1)家用液化气的主要成分之一是丁烷(C4H10),当1kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×104kJ,试写出表示丁烷燃烧热的热化学方程式:______
(2)已知:C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为______
(3)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.4kJ?mol-1
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ?mol-1
写出CO(g)还原FeO(s)得到Fe(s)体和CO2(g)的热化学反应方程式:______.
参考答案:(1)当1kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×104kJ,1mol丁烷完全燃烧放热2900KJ;依据燃烧热概念写出热化学方程式:C4H10(g)+132O2(g)=4CO2(g)+H2O(l)△H=-2900KJ/mol,故答案为:C4H10(g)+132O2(g)=4CO2(g)+H2O(l)△H=-2900KJ/mol;
(2)设碳粉xmol,则氢气为(0.2-x)mol,则
C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
1? ?393.5kJ
x? 393.5xkJ
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
2? 483.6kJ
(0.2-x)mol?241.8(0.2-x)kJ
所以393.5xkJ+241.8(0.2-x)kJ=63.53kJ,
解得x=0.1mol,
则炭粉与H2的物质的量之比为0.1mol:0.1mol=1:1;
故答案为:1:1;
(3)①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.4kJ?mol-1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ?mol-1
依据盖斯定律计算①×3-③×2+②得到:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0KJ/mol
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0KJ/mol.
本题解析:
本题难度:一般
3、填空题 已知两个反应式:
CH≡CH(g) +H2 (g) → CH2= CH2 (g) ; △H =-174kJ·mol-1
CH≡CH(g) +2H2 (g) → C2H6(g); △H =-311kJ·mol-1
则CH2= CH2(g) +H2(g) → C2H6 (g) 的反应热为
参考答案:-137kJ/mol
本题解析:根据盖斯定律可知,②-①即得到CH2= CH2(g) +H2(g) C2H6 (g),所以该反应的反应热△H=-311kJ/mol+174kJ/mol=-137kJ/mol。
C2H6 (g),所以该反应的反应热△H=-311kJ/mol+174kJ/mol=-137kJ/mol。
考点:考查反应热的计算
点评:该题是高考中的常见题型和重要的考点,属于基础性试题的考查。主要是考查学生对盖斯定律的了解掌握程度,以及灵活运用盖斯定律解决实际问题的能力。
本题难度:一般
4、选择题 根据下列热化学方程式
(1)C(s)+O2(g)=CO2(g) △H1=-393.5 kJ/mol
(2)H2(g)+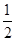 O2(g)=H2O(1) △H2=-285.8 kJ/mol
O2(g)=H2O(1) △H2=-285.8 kJ/mol
(3)CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) △H3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(1)的△H为
A.△H=+244.1kJ/mol
B.△H=-488.3 kJ/mol
C.△H=-996.6 kJ/mol
D.△H=+996.6 kJ/mol
参考答案:B
本题解析:(1)C(s)+O2(g)
本题难度:一般
5、选择题 X、Y、Z、W有如图所示的转化关系,且△H=△H1+△H2,则X、Y可能是( )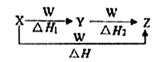
①C、CO ②S、SO2 ③AlCl3、Al(OH)3 ④Na2CO3、NaHCO3
⑤Fe、FeCl2
A.①②③④⑤ B.②④⑤ C.①③④ D.①②③
参考答案:C
本题解析:无机物之间的转化关系要熟练,已知X与W连续反应最终能生成Z,可分析如下:①C与少量O2反应生成CO,CO又可以与O2反应生成CO2,而C与过量O2反应生成CO2,所以符合题意;②S与少量O2反应生成SO2,SO2又可以与O2反应生成SO3,而S与过量O2反应还是生成SO2,不会得到SO3,所以不符合题意;③AlCl3与少量NaOH反应生成Al(OH)3,Al(OH)3又可以与NaOH反应生成NaAlO2,而AlCl3与过量NaOH反应生成NaAlO2,符合题意;④Na2CO3与少量HCl反应生成NaHCO3,NaHCO3又可以与HCl反应生成NaCl,而Na2CO3与过量HCl反应生成NaCl,符合题意;⑤Fe与HCl(或Cl2)反应生成FeCl2(FeCl3),但是FeCl2(FeCl3)不能与HCl(Cl2)再反应,所以不符合题意。
考点:无机物之间的相互转化,常见物质的化学反应要熟练
点评:只要熟记常见物质的性质和相关化学反应,此题可迎刃而解。
本题难度:一般