时间:2019-06-28 21:43:53
1、填空题 (15分)已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g) Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
2、填空题 (13分)煤经过化学加工可转化为气体或液体燃料以及各种化工产品,从而提高了煤的利用率。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g)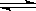 CO(g)+H2(g)△H=131.5kJ·mol-1
CO(g)+H2(g)△H=131.5kJ·mol-1
①下列措施中,不能提高碳的转化率的是?(填字母序号)。
a.容器的容积不变,增加水蒸汽的物质的量
b.缩小容器的容积,增大压强
c.及时将水煤气从容器中移走
d.其他条件不变,升高温度
②又知,C(s)+CO2(g)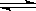 2CO(g)△H=172.5kJ·mol-1
2CO(g)△H=172.5kJ·mol-1
则CO(g)+H2O(g)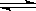 CO2(g)+H2(g)的焓变(△H)为?。
CO2(g)+H2(g)的焓变(△H)为?。
(2)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2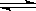 CH3OH(g)。甲醇是一种燃料,可用于设计燃料电池。下图是甲醇燃料电池的原理示意图。
CH3OH(g)。甲醇是一种燃料,可用于设计燃料电池。下图是甲醇燃料电池的原理示意图。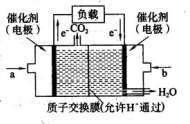 ?①a处通入的是?(填物质名称),左侧电极上发
?①a处通入的是?(填物质名称),左侧电极上发
生?(填“氧化”或“还原”)反应。
②该电池工作过程中,H+的移动方向为从?到
?(填“左”或“右”)
③该电池正极反应式为?。
④若用该电池提供的电能电解60mL NaCl溶液,设有
0.01molCH3OH完全放电,NaCl足量,且电解产生的
Cl2全部溢出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=?。
(3)将等量的CO(g)和H2O(g)分别通入到容积为2L的恒容密闭容器中进行如下反应,
CO(g)+H2O(g)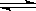 CO2(g)+H2(g)△H=akJ·mol-1,得到下列数据:
CO2(g)+H2(g)△H=akJ·mol-1,得到下列数据: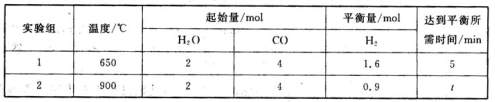
①在实验1中,以v(CO2)表示该反应的反应速率为?mol·L-1·min-1;
②在实验2中,t?5。(填“>”、“<”或“=”)
3、选择题 对气体反应:mA+nB eC 温度(T)、压强(P)、时间(t)与生成物的体积百分数C%的关系图,下列结论正确的是(?)
eC 温度(T)、压强(P)、时间(t)与生成物的体积百分数C%的关系图,下列结论正确的是(?)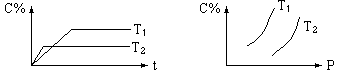
A.m+n>e
B.m+n<e
C.正反应是吸热反应
D.逆反应是放热反应
4、填空题 (8分) A(g)+2B(g)  2C(g)的反应中,时间t与C的体积分数(C%)的函数关
2C(g)的反应中,时间t与C的体积分数(C%)的函数关
系如图所示。回答下列问题:
(1)图A中若两条曲线分别表示在100℃和400℃时的C%与时间t的函数关系,则P表示的温度为?℃,
从P、Q分析反应A(g)+2B(g)  2C(g)是?反应(填“吸热”或“放热”);
2C(g)是?反应(填“吸热”或“放热”);
(2)图B中P表示的温度为?℃,反应A(g)+2B(g)  2C(g)是?反应(填“吸热”或“放热”)。
2C(g)是?反应(填“吸热”或“放热”)。
5、选择题 恒温恒容的三个密闭容器,N2(g)+3H2(g) 2NH3(g)?△H=-92.4 kJ/mol。实验测得起始、平 衡时的有关数据如下表。下列叙述正确的是
2NH3(g)?△H=-92.4 kJ/mol。实验测得起始、平 衡时的有关数据如下表。下列叙述正确的是
| 容器 编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |