时间:2019-06-28 21:34:34
1、选择题 将一定质量的Mg,Zn,Al混合物与足量稀H2SO4反应,生成H22.8L(标准状况),原混合物的质量可能是
A.2g
B.4g
C.7.8g
D.10g
参考答案:BC
本题解析:略
本题难度:一般
2、选择题 在浓度均为6 mol·L-1的盐酸和硫酸各100 mL溶液中,分别加入等质量的铁粉,充分反应后生成气体体积比为2∶3,则加入铁粉的质量是
A.11.2 g
B.25.2 g
C.16.8 g
D.33.6 g
参考答案:B
本题解析:若铁粉过量,则生成气体的体积之比为1:2,充分反应后生成气体体积比为2∶3,可知铁粉对盐酸过量,对硫酸不足,铁与盐酸反应生成氢气为0.3mol,则与硫酸反应生成氢气0.45mol,参加反应的铁粉的物质的量为0.45mol,质量为0.45mol×56g/mol="25.2g" ,答案选B。
考点:通过铁粉与酸的反应考查过量计算
本题难度:一般
3、计算题 某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。请填空: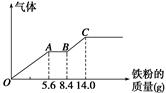
(1)AB段的反应的离子方程式为 ;
(2)原混合酸中NO3-物质的量浓度为 mol·L-1;
(3)原混合物中H2SO4物质的量为 mol。
参考答案:(1). Fe+2Fe3+=3Fe2+ (2). 1.0 (3). 0.5
本题解析:
试题分析:某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中的一份混合液中加入铜粉,铜被硝酸氧化为铜离子。由于n(Cu)=9.6g/64g·mol-1="0.15" mol根据离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知n(NO3-)=(3/2)n(Cu)=0.1mol.所以C(NO3-)=n/V=0.1mol/0.1L="1.0" mol/L.向另一份中逐渐加入铁粉,各个阶段发生的反应为:O→A:Fe+4H++NO3-=Fe3++NO↑+2H2O;A→B:Fe+2Fe3+=3Fe2+;B→。C:Fe+2H+=Fe2++H2↑发生第一个反应消耗氢离子的物质的量为n ( H+)=4n(NO3-)=0.4mol,发生第三个反应消耗的氢离子的物质的量为:n ( H+)="2n" (Fe)=2(14.0-8.4)g/56g.mol-1.="0.2" mol. n ( H+)总=0.4mol+0.2mol=0.6mol.因为n ( H+)总=2n(H2SO4)+n(HNO3),硝酸产生的氢离子和硝酸根离子相等,所以n(H2SO4)="n" ( H+)总-n(HNO3)={0.6mol-0.1mol}/2="0.25" mol.原来的混合溶液平均分成两份,每份含有硫酸0.25 mol,所以一共含硫酸的物质的量为0. 5 mol。
考点:考查硫酸、硝酸的混合液与变价金属发生在各个阶段的反应及实质的问题。
本题难度:困难
4、填空题 (1)已知10g CaCO3分解需要吸收17.56kJ 热量,请写出碳酸钙分解的热化学反应方程式: 。
(2)加热5.00 g碳酸钠和碳酸氢钠的混合物,反应完成后混合物的质量减少了0.31 g,则原混合物中碳酸钠的质量为 g。
参考答案:(4分)(1)CaCO3(s)=CaO(s) + CO2(g) ΔH=+175.6kJ·mol-1 (2)4.16
本题解析:(1)10g CaCO3分解需要吸收17.56kJ 热量,则1mol即100g碳酸钙分解需要消耗的能量是175.6kJ,因此该反应的热化学方程式是CaCO3(s)=CaO(s) + CO2(g) ΔH=+175.6kJ·mol-1。
(2)碳酸氢钠分解的方程式是2NaHCO3 Na2CO3+H2O+CO2↑ △m↓
Na2CO3+H2O+CO2↑ △m↓
2×84g 106g 62g
m 0.31g
解得m=(62g×0.31g)÷168g=0.84g
所以原混合物中碳酸钠的质量为5.00g-0.84g=4.16g
考点:考查热化学方程式的书写、混合物的有关计算
点评:该题是基础性试题的考查,难度不大,有利于培养学生规范的答题能力,在计算碳酸钠的质量时,注意利用好差量法,注意有关解题方法的归纳和总结。
本题难度:一般
5、选择题 某物质A加热时按下式分解:2A=3B+2C+D(产物均为气体),现测得由生成物组成的混合气体的密度是同温同压下H2密度的22.86倍。则反应物A的相对分子质量为(?)
A.22.86
B.45.72
C.80.01
D.137.16
参考答案:D
本题解析:由生成物组成的混合气体的密度是同温同压下H2密度的22.86倍,则生成物的平均相对分子质量是22.86×2=45.72。设参加反应的A的物质的量是2mol,则根据质量守恒定律可知,2M÷(3+2+1)=45.72,解得M=137.16,所以答案选D。
点评:该题的关键是是依据阿伏加德罗定律及其推论,得出生成物的平均相对分子质量,然后依据质量守恒定律列式计算即可。
本题难度:一般